
科学研究
科研进展
刘峰团队建立新型静脉血栓疾病模型
2021-10-26
成熟的红细胞富含血红蛋白,具有携带氧气的功能,对维持机体的稳态至关重要1。红细胞缺陷会导致多种疾病的发生,包括血红蛋白异常性贫血、红细胞溶解性贫血以及血栓等2-4。其中,血栓的发生严重危害了人类的健康5。目前,结扎下腔静脉模型、自由基血栓形成模型和基因敲除模型等已被广泛应用于小鼠静脉血栓研究6-7。这些模型主要通过改变血流、损伤内皮以及调节凝集因子引发血栓形成。此外,苯肼处理可以通过损伤红细胞,导致其磷脂酰丝氨酸外翻以及自由基产生,进而引发血栓发生8。通过动物疾病模型研究血栓的发生,为探究其机制和寻找新的治疗手段提供了帮助。然而,血栓形成的动态过程以及红细胞参与的血栓形成机制仍有待探索。
2021年10月26日,干细胞与再生医学研究院刘峰研究员团队在eLife杂志发表题为The chromatin-remodeling enzyme Smarca5 regulates erythrocyte aggregation via Keap1-Nrf2 signaling的论文。该工作发现:斑马鱼smarca5突变体红细胞发生异常聚集并沉积在尾部静脉。深入机制探索发现,Smarca5通过调控Keap1-Nrf2信号通路调节红细胞聚集。该红细胞聚集模型能部分模拟静脉血栓,为其作为血栓疾病模型进行发病机制探索和药物筛选奠定了基础。
研究人员首先从smarca5突变体红细胞异常聚集的表型出发,进行血栓疾病模型的表型确认和机制研究。在smarca5突变体发育至受精后第2天,血细胞发生异常聚集并沉积在尾部静脉。通过荧光显微镜观察gata1:dsRed标记的红细胞在突变体中的聚集表型,研究人员发现,红细胞在突变体尾部静脉血管(kdrl:GFP)内发生聚集。随后,研究人员用血栓治疗药物Argatroban处理smarca5突变体,结果显示Argatroban处理可以部分缓解血块的产生。因此,smarca5突变体可以部分模拟血栓疾病。
染色质重塑因子Smarca5可以调节核小体间距,进而影响基因的转录9。为了探究smarca5缺失对红细胞转录组和染色质可接近性的影响,研究人员采用RNA-seq和ATAC-seq对smarca5突变体和对照组胚胎红细胞进行分析。基因组变异分析显示,smarca5突变后,红细胞中转录下降的基因主要与“Gata1下游靶点”, “红细胞携氧”等通路相关;而上调的基因主要与“应激反应”,“衰老”和“细胞氧化”等通路相关。在突变体组中染色质开放性和转录水平同时上调和下调的基因中,keap1a启动子区的染色质开放性以及转录表达在smarca5缺失后出现下降。Keap1-Nrf2系统是一种进化保守的氧化应激防御机制10-11。在细胞质中,Keap1可以与Nrf2结合,阻止Nrf2的入核以及下游靶基因的激活。在smarca5突变的红细胞中,研究人员发现Nrf2的靶基因被过度激活,其中包括hmox1a。Hmox1可以催化血红素降解为胆绿素、一氧化碳和Fe2+,因此hmox1的过度激活可引起细胞的氧化损伤12。为了进一步探究Keap1-Nrf2信号通路是否参与红细胞聚集的表型,研究人员在smarca5突变体胚胎中进行keap1a过表达或hmox1a敲降实验。结果显示,过表达keap1a或敲降hmox1a可部分减少红细胞的聚集。以上结果说明,smarca5部分通过Keap1-Nrf2信号通路调节红细胞异常聚集的表型。
综上所述,该研究首次发现了smarca5突变体红细胞异常聚集的表型,并初步解析了smarca5调控红细胞聚集的机制,与此同时,研究人员建立了一种新的静脉血栓疾病模型,为其作为血栓疾病模型并用于药物筛选等临床转化研究奠定基础。
干细胞与再生医学研究院刘峰研究员为论文通讯作者,生物岛实验室博士后丁岩岩、清华大学博士研究生李雨哲与中国科学院动物研究所硕士研究生赵梓倩为论文共同第一作者,清华大学张强锋教授参与此项工作。该研究得到了国家重点研发计划、国家自然科学基金以及中国科学院的资助。
文章链接:https://elifesciences.org/articles/72557
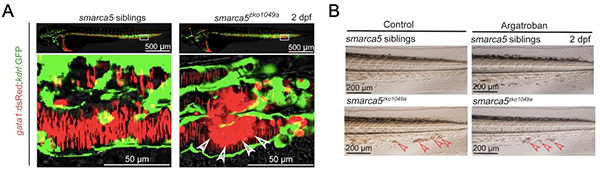
图示:smarca5突变体红细胞发生异常聚集
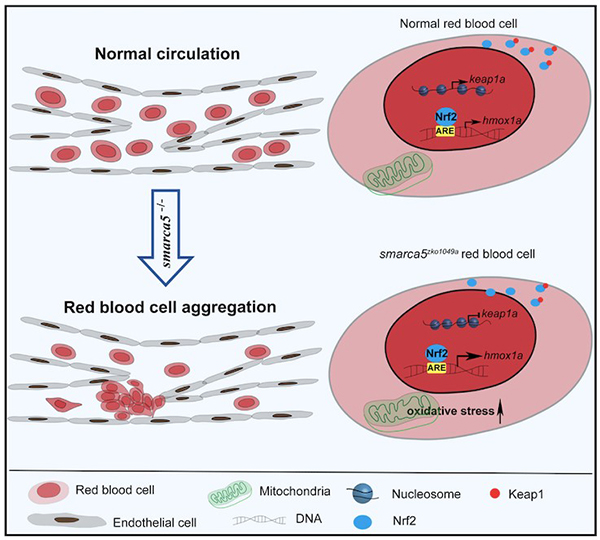
图示:Smarca5通过调控Keap1-Nrf2信号通路调节红细胞聚集
附件:
