
科学研究
科研进展
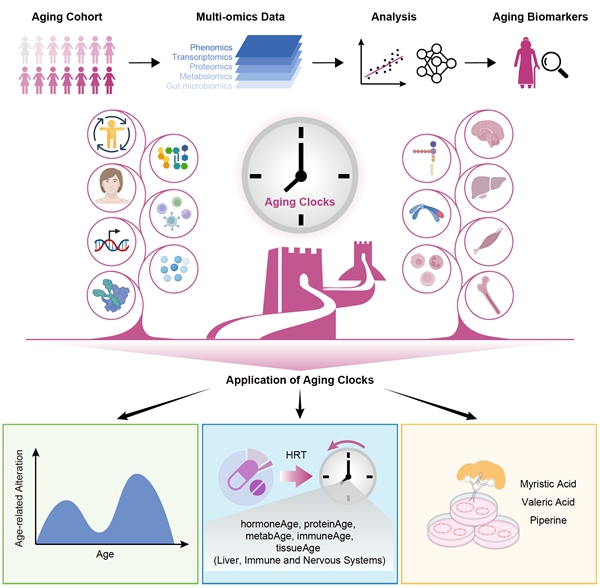
合作建立中国女性复合衰老时钟
2023年7月28日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究员、中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员、衢州市人民医院张峰研究员、中国科学院北京基因组研究所(国家生物信息中心)杨运桂研究员合作在Med杂志在线发表题为“Determining a Multimodal Aging Clock in a Cohort of Chinese Women”的研究论文。该研究首次系统挖掘了中国女性衰老跨5个维度的生物学标志物,建立了中国女性的多层次复合时钟,并利用该时钟系统揭示了中国女性衰老的动态变化规律以及激素替代疗法对于女性衰老的潜在干预效果。该研究建立并丰富了人群衰老的系统生物医学研究范式,为衰老时钟的发展和临床应用提供了坚实基础。 衰老是一个亘古至今的话题。《科学》杂志发布的125个重大科学问题其中之一就有“我们可以阻止自己的衰老吗?”。而如何“度量”衰老,精准地衡量衰老阶段和程度是发展健康监测、个性化医疗和评估衰老干预效果的重要依据和前提。同发育过程的高度程序化不同,衰老的速度和程度存在高度异质性。例如,生活中有些人看起来比同龄人更年轻,而有些人看起来更老,这让我们意识到,人类的“时序年龄(Chronological Age)”或称为“日历年龄”、“身份证年龄”,往往并不能直接与其生物学年龄(Biological Age)划等号。我们究竟有多老?有没有一把可以度量衰老的尺子?如何判断一个人是未老先衰还是老当益壮?如何预测器官退变的关键时间节点?如何评价不同衰老干预手段的效果?面对这些与衰老转化研究密切相关的问题,亟需建立能够评估人类生物学年龄的“衰老时钟”。 另一方面,衰老是一个受多因素影响的复杂过程。尽管目前已有研究尝试从不同的单一维度对衰老进行度量,然而衰老的复杂性和异质性决定了单一层次的衰老时钟存在着固有的局限。至今尚未建立系统整合跨宏微观及多维度参数的人类生物学年龄评估体系,这严重制约了衰老评估、预警和干预领域的发展及其临床转化应用。此外,衰老过程具有明显的性别差异。女性在衰老机制和动力学上都与男性有很大的区别。迄今为止,针对女性的系统衰老研究,特别是专门的女性衰老时钟研究还罕有报道。 2023年7月28日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究员、中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员、衢州市人民医院张峰研究员、中国科学院北京基因组研究所(国家生物信息中心)杨运桂研究员合作在Med杂志在线发表题为“Determining a Multimodal Aging Clock in a Cohort of Chinese Women”的研究论文。该研究首次系统挖掘了中国女性衰老跨5个维度的生物学标志物,建立了中国女性的多层次复合时钟,并利用该时钟系统揭示了中国女性衰老的动态变化规律以及激素替代疗法对于女性衰老的潜在干预效果。该研究建立并丰富了人群衰老的系统生物医学研究范式,为衰老时钟的发展和临床应用提供了坚实基础。 该研究首先在浙江省衢州市建立了涵盖20-66岁中国女性的自然人群队列,志愿者入选条件为长期在当地居住,无重大疾病,并在受试前对其饮食和作息进行统一建议,这降低了增龄外因素对研究带来的不确定性影响。利用多参数表型组、(单细胞)转录组、蛋白组、代谢组和微生物组等手段,结合人工智能等分析方法,研究系统探究了中国女性衰老的多维特征,鉴定了一系列具有临床转化价值的新型衰老生物标志物。在表型水平,人的动作灵活性和手脑协作能力等行动协调能力随着增龄显著降低;血清中的卵泡刺激激素(FSH)、促黄体激素(LH)随增龄显著升高,而抗缪勒氏激素(AMH)水平则与年龄呈负相关。在转录水平,研究人员发现血液中幼稚态T细胞的减少和毒性T细胞增加是免疫细胞衰老的主要特征,并鉴定到LRRN3、CACHD1、SATB1三个可能指征年龄相关的幼稚态T细胞减少的基因。而在蛋白层次,该研究揭示了血浆中载脂蛋白(如APOE、APOC4)和炎症相关蛋白(如CHIT1、LILRA2)的上调与增龄高度正相关,其中载脂蛋白的升高可能指示了人类肝衰老的程度。在代谢层次,研究人员观察到老年人血浆中主要发生了脂质的积累和类固醇激素相关代谢物的减少。此外,研究还发现补充随增龄下调的血浆代谢物(如豆蔻酸、戊酸等)能够显著延缓人动脉内皮细胞衰老、改善内皮细胞的功能,提示了这些代谢物具有干预人类血管衰老的潜力。 通过整合衰老多组学数据,研究人员发现中国女性健康状态増龄伴随的三个方面显著变化:炎症激活、激素调节紊乱以及多组织功能退化(主要表现为骨密度丢失、肺功能降低和肝损伤退行标志物积累等)。基于所得到的人群多组学数据集,研究人员进一步建立了中国女性的多维衰老时钟,包括面部时钟、表型时钟、转录时钟、蛋白时钟和代谢时钟。该研究同时还创新性地建立并应用了具有特定功能注释的衰老时钟,包括激素时钟、免疫时钟、脂质时钟和组织衰老时钟(包括肝脏、肌肉、神经系统和造血系统)。通过系统比较不同种类衰老时钟,研究人员发现相较于其他单层次衰老时钟,多维复合衰老时钟具有更高的预测准确性,并且激素衰老时钟与多种衰老时钟具有较高相关性,提示激素变化与女性衰老的多个方面具有密切联系。 此外,该研究通过比较不同年龄段人群的衰老动力学曲线,发现受试女性在30岁和50岁两个时间点具有明显的衰老变化加剧的动力学特征。其中,30岁左右的衰老变化主要表现为代谢水平的脂质累积和类固醇减少。而到50岁左右时,女性衰老进程在器官、细胞和分子等多个层次均发生剧烈变化,包括多种增龄高度相关指标的陡升或陡降。值得注意的是,由于30岁和50岁大致对应了志愿者生育和更年期的分界点,这些事件可能导致女性内分泌水平发生较大波动,该结果再一次说明激素水平的改变可能是女性衰老的关键影响因素。 为验证多维衰老时钟对于衰老干预评估的应用能力,研究人员将经历长期激素替代疗法的志愿者和同年龄段未接受过治疗的人群进行观察比较,发现接受激素替代疗法的志愿者的多个衰老参数得到一定程度的缓解,包括幼稚态CD8+ T细胞的增加和炎症蛋白、肝损伤标志物的降低等。相对应的,这些志愿者的激素时钟、免疫时钟、蛋白时钟和代谢时钟等多种衰老时钟的速率也表现出不同程度的缓解趋势。这一结果说明该研究建立的衰老时钟具有评价衰老干预手段的临床应用价值。 综上,该研究首次建立了中国女性的多维衰老标志物景观图,在群体水平详细剖析了女性不同层次的衰老特征,创新性地建立了中国女性的复合衰老时钟,并证明了这些时钟具有评价人类衰老干预效果的潜力(图1)。利用交叉学科手段,该研究从衰老的监测、度量和干预三个角度进行了探究,为人类复合衰老时钟的建立和发展提供了宝贵的范式和资源。以这些研究为基础,通过扩大人群数量和地域范围,并结合前沿数据采集和分析技术,未来将有望从系统维度解析中国人群的衰老特征,建立评估人类生理年龄的衰老指数(Index of Chinese Aging Score, iCAS),助力系统老年医学的发展。这些精准衰老度量手段的建立,将有助于制定个性化的临床健康指导方案,发展针对特定老年疾病的精准预警和诊疗策略,为推动健康老龄化的战略需求提供支撑保障。 中国科学院北京基因组研究所(国家生物信息中心)博士研究生李嘉明、熊沐钊、衢州市人民医院傅向红主任医师、中国科学院北京基因组研究所(国家生物信息中心)范艳玲助理研究员和北京邮电大学董辰教授为文章的共同第一作者。中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究员、中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员、衢州市人民医院张峰研究员、中国科学院北京基因组研究所(国家生物信息中心)杨运桂研究员为文章的共同通讯作者。 原文链接:https://doi.org/10.1016/j.medj.2023.06.010图1. 中国女性衰老时钟的建立及其应用
2023-08-01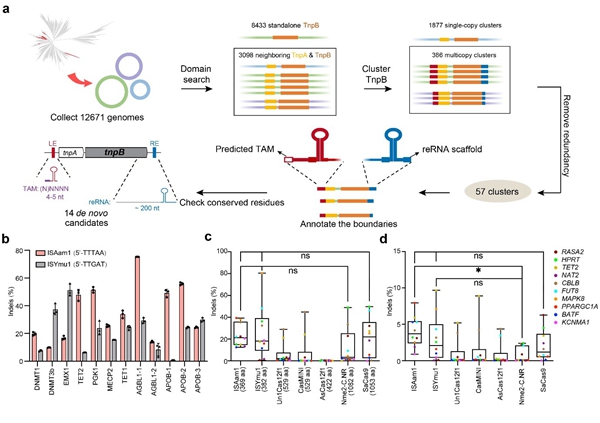
王皓毅和张勇团队合作开发新型TnpB微型基因编辑工具
2023年6月29日,中国科学院动物研究所/北京干细胞与再生医学研究院王皓毅研究员、项光海博士和中国科学动物研究所张勇研究员团队合作在Nature Biotechnology杂志在线发表题为Evolutionary mining and functional characterization of TnpB nucleases identify efficient miniature genome editors的研究论文。Nature Biotechnology杂志同时发表了Research Briefing文章对该研究成果进行了总结和展望(Hypercompact genome editors are discovered by mining a transposon family)。该研究创新性地建立了对TnpB相关靶向基因编辑系统的大规模挖掘方法,并首次对多样性极其丰富的TnpB核酸酶进行了大规模挖掘,从而鉴定到了33个在原核系统具有靶向编辑活性的TnpB蛋白,其中5个在真核系统具有活性。 CRISPR-Cas技术促进了生物医学研究。除了广泛使用的Cas9系统之外1,其他CRISPR亚型也不断被发现并应用于基因编辑,例如能够装载进AAV病毒的SaCas9(1053 aa)2以及更小的微型CRISPR-Cas系统Cas12f(400~550 aa)3-6。已发表的工作重建了CRISPR-Cas系统的起源,发现原核转座子编码的IscB和TnpB蛋白分别是Cas9与Cas12核酸酶的祖先7。这些祖先蛋白尺寸较小,但其是否具备核酸酶活性缺乏证据;直到2021年,IscB和TnpB被发现在非编码RNA(omegaRNA或reRNA)引导下切割双链DNA,证实了其与CRISPR-Cas系统相似的工作机制8, 9。TnpB由IS200/IS605等原核转座子家族编码,并被推测参与转座子的扩张9。TnpB的分布非常广泛,在目前已知的基因组存在超过百万的拷贝8;但此前的研究只发现了一种在人类细胞中具有活性的TnpB核酸酶(ISDra2),且效率不高9;因此,TnpB这一有潜力作为微型编辑工具的多样性宝库急需系统性的挖掘和研究。同时,由于可能推动转座子扩张,TnpB靶向切割DNA所依赖的关键元件(如reRNA)与转座子或存在关联,因而可以基于转座子信息进行预测,这将为工具的开发提供便利。 2023年6月29日,中国科学院动物研究所/北京干细胞与再生医学研究院王皓毅研究员、项光海博士和中国科学动物研究所张勇研究员团队合作在Nature Biotechnology杂志在线发表题为Evolutionary mining and functional characterization of TnpB nucleases identify efficient miniature genome editors的研究论文。Nature Biotechnology杂志同时发表了Research Briefing文章对该研究成果进行了总结和展望(Hypercompact genome editors are discovered by mining a transposon family)。该研究创新性地建立了对TnpB相关靶向基因编辑系统的大规模挖掘方法,并首次对多样性极其丰富的TnpB核酸酶进行了大规模挖掘,从而鉴定到了33个在原核系统具有靶向编辑活性的TnpB蛋白,其中5个在真核系统具有活性。 研究团队首先对ISfinder原核转座子数据库中IS605编码的TnpB蛋白进行了全面的分析和挖掘,从64个候选项中鉴定出了25种在大肠杆菌中活跃的系统,其中3种在人类细胞中具有基因编辑活性。对于功能数据的进一步分析则揭示TnpB蛋白相关的reRNA骨架与IS200/IS605转座子的RE序列具有完全重叠的3’末端;而TAM序列则与转座子上游的插入位点序列相同。该结果表明在TnpB系统中,与RNA介导的编辑器相关的三大要素(核酸酶、gRNA骨架和TAM序列)均可通过生物信息分析准确预测;这为大规模筛选高活性TnpB核酸酶奠定了基础。这一发现同时也进一步确定了TnpB在IS605中的功能,即作为归巢核酸酶切割转座之后的原位点,从而诱导重组修复实现转座子的拷贝数扩增。 研究团队随后从4个方面对TnpB相关的reRNA骨架进行了分析,结果表明:1)reRNA骨架在120-300nt的长度范围内均能够有效发挥功能,而120-140nt的reRNA骨架活性最强;2)reRNA骨架在3’末端的碱基对其功能有重要影响,单一碱基的突变即会显著降低编辑活性;3)靶向序列的长度在16-20nt为最佳;4)靠近TAM端的12nt是TnpB编辑器的核心序列。研究者进一步整合分析了影响TnpB编辑器活性的潜在因素,发现来自细菌的、由多拷贝转座子编码的、具有完整蛋白结构域和保守氨基酸的TnpB编辑器更为活跃。 最后,团队基于上述理解,建立了大规模挖掘全新TnpB基因编辑器的方法(下图),对部分未经转座子注释的原核基因组进行了从头注释和功能预测,并直接在人类细胞系中筛选获得了新的微型高活性TnpB编辑器ISAam1(369 aa)和ISYmu1(382 aa)。和其他微型Cas蛋白的平行比较发现,ISAam1和ISYmu1的活性与SaCas9相当,显著高于数种已报道的Cas12f蛋白及其变体。 综上,该研究建立了适用于TnpB编辑器的大规模筛选体系,进一步证明了TnpB在转座子扩张中的功能,并对这一类编辑器进行了系统的功能解析,从而获得了目前最小的具备原创知识产权的微型基因编辑器。考虑到体内基因治疗和细胞治疗经常因Cas蛋白过大而递送受限,这一成果将推动相关方面的研究和临床应用。 该研究由中国科学院动物研究所/北京干细胞与再生医学研究院完成。北京干细胞与再生医学研究院/中国科学院动物研究所王皓毅研究员、项光海博士和中国科学动物研究所张勇研究员为文章的共同通讯作者。项光海博士、研究生李源清、孙晶、霍雍元为文章的共同第一作者。王皓毅研究员长期致力于新型基因编辑工具的开发(Cell Discovery 2019)及CAR-T细胞治疗研究(Cancer Cell 2022);张勇研究员则致力于转座子等机制介导的新重复基因的起源和进化研究(Nature Ecology & Evolution 2022、Nature Communications 2021)。两个团队的合作推动了对TnpB的挖掘。该研究得到了科技部、中国科学院先导专项、农业农村部和国家自然科学基金委等项目的资助。 参考文献: 1. Hsu, P.D., Lander, E.S. & Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell 157, 1262-1278 (2014). 2. Ran, F.A. et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature 520, 186-191 (2015). 3. Bigelyte, G. et al. Miniature type V-F CRISPR-Cas nucleases enable targeted DNA modification in cells. Nat Commun 12, 6191 (2021). 4. Xu, X. et al. Engineered miniature CRISPR-Cas system for mammalian genome regulation and editing. Mol Cell 81, 4333-4345 e4334 (2021). 5. Wu, Z. et al. Programmed genome editing by a miniature CRISPR-Cas12f nuclease. Nat Chem Biol 17, 1132-1138 (2021). 6. Kim, D.Y. et al. Efficient CRISPR editing with a hypercompact Cas12f1 and engineered guide RNAs delivered by adeno-associated virus. Nat Biotechnol 40, 94-102 (2022). 7. Kapitonov, V.V., Makarova, K.S. & Koonin, E.V. ISC, a Novel Group of Bacterial and Archaeal DNA Transposons That Encode Cas9 Homologs. J Bacteriol 198, 797-807 (2015). 8. Altae-Tran, H. et al. The widespread IS200/IS605 transposon family encodes diverse programmable RNA-guided endonucleases. Science 374, 57-65 (2021). 9. Karvelis, T. et al. Transposon-associated TnpB is a programmable RNA-guided DNA endonuclease. Nature 599, 692-696 (2021).
2023-07-03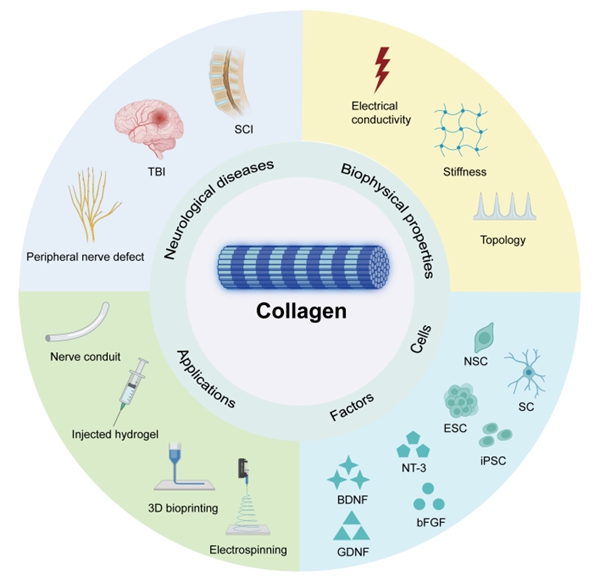
生物制造研究组近期取得干细胞生物材料开发系列进展
干细胞是器官制造的重要细胞来源,中国科学院动物研究所顾奇与国家干细胞资源库吴骏、华东理工大学郭美锦合作,开发一种以透明质酸(HA)为核心材料的新型微载体,实现hESC衍生的间充质干细胞(IMRCs)的规模化扩增,最高产量超过每毫升100万个细胞(图1)。相关研究工作以“A scalable culture system incorporating microcarrier for specialised mesenchymal stem cells from human embryonic stem cells”为题发表于Materials Today Bio,该论文第一作者为动物研究所博士研究生高婷婷,博士研究生赵喜源和郝捷副研究员。 干细胞是器官制造的重要细胞来源,中国科学院动物研究所顾奇与国家干细胞资源库吴骏、华东理工大学郭美锦合作,开发一种以透明质酸(HA)为核心材料的新型微载体,实现hESC衍生的间充质干细胞(IMRCs)的规模化扩增,最高产量超过每毫升100万个细胞(图1)。相关研究工作以“A scalable culture system incorporating microcarrier for specialised mesenchymal stem cells from human embryonic stem cells”为题发表于Materials Today Bio,该论文第一作者为动物研究所博士研究生高婷婷,博士研究生赵喜源和郝捷副研究员。 在此微载体基础上,中国科学院动物研究所顾奇,分别与首都医科大学附属北京同仁医院张明珠、国家干细胞资源库郝捷、吴骏,合作开发具有空间限制作用的HA微载体(图2)、干细胞来源的高强度细胞外基质膜片和水凝胶(图3),并对胶原蛋白基质在神经组织制造应用中的基本问题进行了综述(图4)。相关工作分别以“Cartilage Lacuna-Inspired Microcarriers Drive Hyaline Neocartilage Regeneration”为题发表于Advanced Materials,第一作者为动物研究所-北京同仁医院联合培养博士研究生丁声龙、动物研究所博士研究生赵喜源、北京同仁医院博士研究生熊维;以“High-Strength Cell Sheets and Vigorous Hydrogels from Mesenchymal Stem Cells Derived from Human Embryonic Stem Cells”为题发表于ACS Applied Materials & Interfaces,第一作者为动物研究所博士研究生郭保杰、段勇超(已毕业)、助理研究员李仲文;以“Collagen for neural tissue engineering: Materials, strategies, and challenges”为题发表于Materials Today Bio,第一作者为动物研究所博士研究生黄文慧,动物研究所-北京同仁医院联合培养博士研究生丁声龙。 上述工作得到了中国科学院战略性先导科技专项(XDA16020802,XDA16021102, XDA16030701/702,XDA16040502/504)、国家重点研发计划(2019YFA0110900,2021YFA1101600, 2020YFA0804000,2018YFE0204400)、国家自然科学基金(T2222029,U21A20396)、北京干细胞与再生医学院孵化基金(2022FH110, 2022FH117)等项目支持。 论文信息: 1. A scalable culture system incorporating microcarrier for specialised mesenchymal stem cells from human embryonic stem cells,论文网站链接:https://www.sciencedirect.com/science/article/pii/S2590006423001229?via%3Dihub。 2. Cartilage Lacuna-Inspired Microcarriers Drive Hyaline Neocartilage Regeneration,论文网站链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202212114。 3. High-Strength Cell Sheets and Vigorous Hydrogels from Mesenchymal Stem Cells Derived from Human Embryonic Stem Cells,论文网站链接:https://pubs.acs.org/doi/10.1021/acsami.3c03117。 4. Collagen for neural tissue engineering: Materials, strategies, and challenges,论文网站链接https://www.sciencedirect.com/science/article/pii/S2590006423000996?via%3Dihub图1. 基于HA微载体的干细胞扩增图2. 仿生软骨陷窝的透明质酸微载体图3. 干细胞衍生的细胞外基质膜片和水凝胶图4. 基于胶原蛋白的神经组织制造
2023-07-01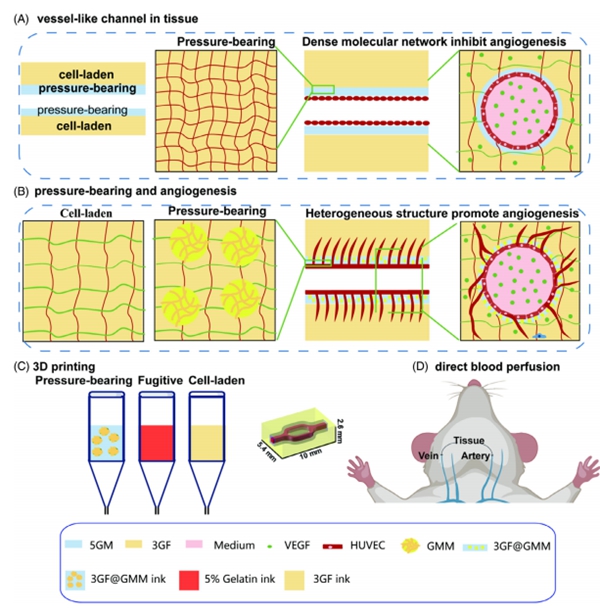
生物制造研究组近期取得器官制造系列进展
宏观血管网制造和微观细胞运动机制是大尺度复杂器官构建基础,生物制造研究组(https://www.gulab.info)近期通过开发微凝胶、修饰胶原及生物界面等研究手段的介入取得了器官制造的系列进展 宏观血管网制造和微观细胞运动机制是大尺度复杂器官构建基础,生物制造研究组(https://www.gulab.info)近期通过开发微凝胶、修饰胶原及生物界面等研究手段的介入取得了器官制造的系列进展。 (1)复杂管网制造 血管网是营养物质传递的基础,是器官制造面临的首要难题。现有合成手段制造的血管虽然有较好的力学强度但活性低,无法与下一级血管形成互联,只能作为单一尺度的血管移植替代方案;已有报道能够实现模拟血管出芽,但是承压能力有限,无法满足大体积制造的需求。为了解决血管承压与生物活性不兼容的难题,中国科学院动物研究所顾奇、沈阳自动化所郑雄飞协同攻关,开发一种微凝胶增强的异质性水凝胶基质(3GF@GMM),结合前期已经发表的一体化打印技术(Adv Healthc Mater, 2021)构建多分支、跨尺度血管化组织,不仅耐受生理血流的剪切力和周向应力,并能模拟血管生成,向管道外出芽,提高营养物质的跨界面输送能力(图1)。相关研究工作以“3D bioprinting microgels to construct implantable vascular tissue”为题发表于Cell proliferation,该论文第一作者为中国科学院动物研究所博士后王新环,并列第一作者包括中国科学院动物研究所博士后刘鑫。 同时,在研究论文的基础上,对大尺度血管化组织中脉管系统制造进行综述,不仅概述了血管网的制造策略,还从设计、墨水、打印、培养四个方面进行了深度剖析,为下一步大尺度复杂组织/器官中的血管网制造奠定基础。相关综述以“Vascularized organ bioprinting: From strategy to paradigm”为题发表于Cell proliferation,该论文第一作者为沈阳自动化所副研究员王赫然和动物研究所博士后刘鑫。 (2)调控细胞三维空间运动 器官制造过程涉及复杂细胞运动,调控细胞/组织在三维环境中的有序组装和跨界面迁移,会为复杂器官制造中奠定理论和技术基础。 中国科学院化学研究所王树与动物研究所顾奇两个团队协同,利用化学修饰方法制备多种反应活性基团修饰的胶原基生物墨水可控胶原原纤维组装,提高内皮细胞的三维组装效率,打印成型的三维组织在培养7天后能够形成密集的内皮细胞组装形成的血管网络(图2)。相关研究工作以“Synthesis of Easily-Processable Collagen Bioinks using Ionic Liquid for 3D Bioprinted Liver Tissue Models with Branched Vascular”为题发表于Science China Chemistry,该论文第一作者为化学研究所高志强和动物研究所博士后刘鑫。 此外,跨界面细胞运动是组织融合生长的典型现象之一,动物研究所顾奇研究组通过微流控生产刚度可控的微载体,构建仿生胚胎,模拟胚外组织侵入子宫过程(图3)。相关研究工作以“Microcarriers promote the through interface movement of mouse trophoblast stem cells by regulating stiffness”为题发表于Bioactive Materials,该论文第一作者为动物研究所博士研究生高子力,郭佳(已毕业),及硕士研究生苟博(已毕业)。 上述工作得到了中国科学院战略性先导科技专项“器官重建与制造”(XDA16020802,XDA16020804)、国家自然科学基金(T2222029,U21A20396,62127811,22021002,22022705)、北京干细胞与再生医学院孵化基金(2022FH125)等项目支持。 论文信息: 1. 3D bioprinting microgels to construct implantable vascular tissue,论文网站链接:https://onlinelibrary.wiley.com/doi/10.1111/cpr.13456 2. Vascularized organ bioprinting: From strategy to paradigm,论文网站链接:https://onlinelibrary.wiley.com/doi/10.1111/cpr.13453 3. Synthesis of Easily-Processable Collagen Bioinks using Ionic Liquid for 3D Bioprinted Liver Tissue Models with Branched Vascular,论文网站链接:https://link.springer.com/article/10.1007/s11426-022-1472-6 4. Microcarriers promote the through interface movement of mouse trophoblast stem cells by regulating stiffness,论文网站链接:https://www.sciencedirect.com/science/article/pii/S2452199X23001524?via%3Dihub图1. 微凝胶增强的3GF血管基质满足生理血流剪切力、周向应力和血管生成图2. 基于胶原蛋白的血管化组织制造图3. 可控刚度微载体研究干细胞跨界面运动
2023-06-30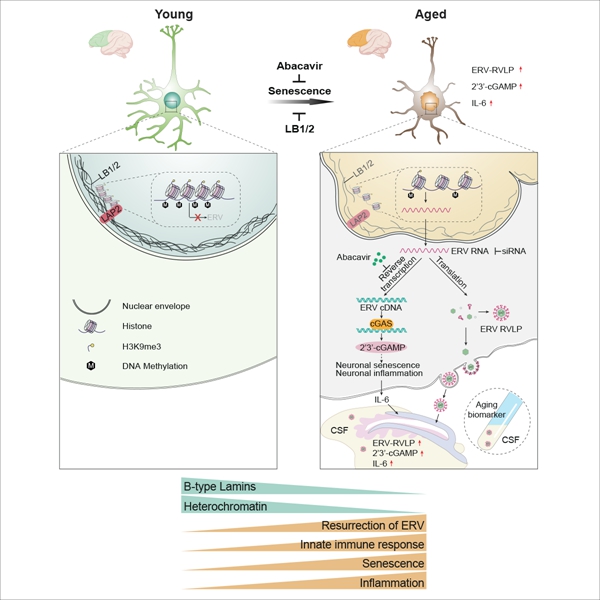
干细胞院合作揭示基因组古病毒复活驱动脑衰老
2023年6月1日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组联合中国科学院北京基因组研究所张维绮课题组以及首都医科大学宣武医院王思课题组合作在Cell Reports杂志在线发表题为Nuclear lamina erosion-induced resurrection of endogenous retroviruses underlies neuronal aging的研究论文。该研究首次系统地解析了灵长类额叶衰老伴随的组织转录组、单核转录组、蛋白质组及全基因组DNA甲基化层次的多维改变,进而利用神经病理学检测体系和体外人类神经元衰老模型,提出核纤层(Nuclear lamina)磨损引起异染色质(Heterochromatin)松弛以及基因组内源性逆转录病毒(Endogenous Retrovirus, ERV)复活,激活细胞天然免疫通路并诱导神经元衰老和炎症的理论,并据此发展可延缓神经元衰老的新型干预策略,为发掘额叶衰老及相关退行性疾病的早期预警标志物和潜在干预靶标提供了重要依据。 额叶是与认知和行为控制有关的脑的重要组成部分。随着年龄增长,额叶功能逐渐退化,其神经解剖学和神经生理学变化是额颞叶痴呆和阿尔茨海默病等神经退行性疾病的基础。然而,认知老化先于神经退行性疾病表征数年出现,这对于人类认知减损的早期诊断和治疗提出了巨大的挑战。此外,由于额叶衰老及其神经元变性涉及复杂的细胞结构和功能变化,加之细胞在表观遗传和基因表达等分子调控水平的复杂性,使得目前对驱动灵长类额叶衰老的细胞和分子机制的认知还非常有限,这严重制约了针对脑衰老及神经退行性疾病的临床评估与干预策略开发。 2023年6月1日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组联合中国科学院北京基因组研究所张维绮课题组以及首都医科大学宣武医院王思课题组合作在Cell Reports杂志在线发表题为Nuclear lamina erosion-induced resurrection of endogenous retroviruses underlies neuronal aging的研究论文。该研究首次系统地解析了灵长类额叶衰老伴随的组织转录组、单核转录组、蛋白质组及全基因组DNA甲基化层次的多维改变,进而利用神经病理学检测体系和体外人类神经元衰老模型,提出核纤层(Nuclear lamina)磨损引起异染色质(Heterochromatin)松弛以及基因组内源性逆转录病毒(Endogenous Retrovirus, ERV)复活,激活细胞天然免疫通路并诱导神经元衰老和炎症的理论,并据此发展可延缓神经元衰老的新型干预策略,为发掘额叶衰老及相关退行性疾病的早期预警标志物和潜在干预靶标提供了重要依据。 研究人员对食蟹猴额叶的衰老过程进行了系统的解析,发现衰老神经元中核纤层磨损(如B型Lamin蛋白的减少)和异染色质的缺失可导致基因组中ERV转录激活并表达出病毒蛋白,进而形成病毒颗粒。在衰老神经元的胞浆中,ERV的反转录产物通过激活cGAS-STING天然免疫通路进而诱发神经元的衰老和炎症反应。研究人员还建立了人类胚胎干细胞衍生的神经元体外衰老模型,并基于此验证了核纤层蛋白Lamin B1和Lamin B2的缺失及其诱导的ERV复活是神经元衰老级联反应中的起始事件。进一步,研究人员通过发展基于靶向ERV或cGAS通路的siRNA基因沉默体系,实现了对人神经元衰老的抑制。最后,研究发现抗艾滋病药物阿巴卡韦可以通过抑制ERV逆转录酶,有效抑制人类神经元的衰老。此外,口服阿巴卡韦的老年小鼠也表现出额叶神经元衰老的延缓及认知能力的改善。 该研究首次揭示了核纤层磨损引起的内源性逆转录病毒复活可以作为人类额叶衰老的驱动力及生物标志物,为脑衰老的科学评估和预警、脑衰老及相关神经退行性疾病的防治提供了新的线索和思路。在技术方面,研究综合运用多层次组学、人类胚胎干细胞衍生的神经元模型、基因沉默和免疫学成像等技术,捕获了ERV古病毒的复活、反转录和激活天然免疫通路等生物学过程,开创了人类脑衰老研究的新视角;在转化医学方面,研究以ERV古病毒复活周期的不同环节为靶标开发出多样化的神经衰老干预技术,为脑衰老相关疾病的防治提供了全新的策略。 该研究系统揭示了介导灵长类额叶衰老及认知功能减退的新型分子通路,为人类脑衰老及神经退行性疾病的科学评估和预警提供了新型的生物标志物,并为发展干预脑衰老及神经退行性疾病的靶向药物奠定了理论基础。未来围绕着脑衰老伴随的ERV古病毒复活,将会涌现出更多的科学问题,例如:ERV激活是否可以发生在其他脑区的特化神经元中?ERV能否通过级联感染年轻神经元或其他神经胶质细胞,介导神经衰老的细胞间传递?ERV能否在不同的基因组位点之间“跳跃”,介导神经细胞的基因组失稳?逆转录酶抑制剂能否延长哺乳动物寿命,能否促进老年个体的健康水平?期待随着科学研究的不断深入,这些谜题将逐一得以解决。 中国科学院动物研究所博士研究生张慧、中国科学院北京基因组研究所博士研究生李嘉明、北京大学第三医院于洋研究员、中国科学院北京基因组研究所任捷研究员、天津医科大学总医院刘强教授和首都医科大学附属北京天坛医院保肇实副教授为文章的并列第一作者。中国科学院动物研究所刘光慧研究员、曲静研究员、中国科学院北京基因组研究所张维绮研究员及首都医科大学宣武医院王思研究员为文章的共同通讯作者。 原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00604-6图1. ERV病毒颗粒(Retrovirus-like particle, RVLP)在衰老的人类神经元中聚集图2. 核纤层磨损诱导的内源性逆转录病毒复活驱动神经元衰老的机制与干预策略
2023-06-01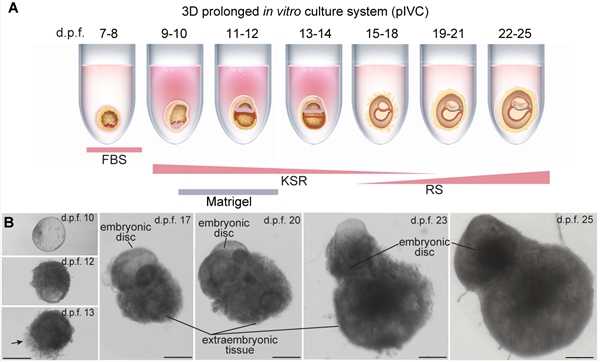
王红梅研究组及合作团队利用食蟹猴胚胎体外培养模型揭示灵长类早期神经胚发育特征
研究者建立了一个可支持食蟹猴胚胎体外发育至受精后25天的3D长时程培养体系,并基于该体系探究了灵长类胚胎中晚期原肠运动和早期神经发育过程中的核心事件和谱系特征。研究者比较了人类和非人灵长类胚胎2D和3D体外培养体系,对不同体系中胚胎的大小和存活率进行评估。研究者发现,2D和3D体系都能支持胚胎发育到d.p.f. 20。在2D体系下,胚胎由于胚外组织发育旺盛而迅速增大,但内部的胚体发育并不好。而在3D体系下,胚胎的胚外组织生长受限,但胚体结构显著发育。这些特征提示2D体系优先支持胚外组织生长,而胚外组织的过度生长可能限制了胚体本身的发育。为了保证胚体的发育,研究者继续优化3D体系。已报道的人类胚胎M-3D体系需要在d.p.f. 9-14的培养基中连续添加Matrigel,以模拟人类胚胎植入后环境。鉴于食蟹猴胚胎植入子宫比人类胚胎浅表,因此,研究者仅在d.p.f. 10-12的培养基中加入Matrigel。优化后的体系能支持33.7%(n = 91)的食蟹猴胚胎发育到d.p.f. 25,该体系被命名为3D长时程培养体系 出生缺陷严重影响国民健康。有数据显示,当前已知的出生缺陷病种超过8000种,其中神经管畸形是常见的一类出生缺陷。出生缺陷的发生与早期胚胎发育异常直接相关。因此,研究早期胚胎发育过程、探究发育机理,是揭示病理性胚胎发生机制,提升相关疾病诊疗效率,从根源上提高人民健康水平的重要前提。 人早期胚胎发育起始于受精卵(胚胎期第0天;day post-fertilization 0;d.p.f. 0)。受精卵经过数次卵裂形成囊胚,囊胚于d.p.f. 7左右种植入母体子宫并进一步发育,于d.p.f. 14启动原肠运动。原肠运动是早期胚胎发育过程中的里程碑事件,在此过程中,胚胎细胞发生大规模分化、迁移和重排,并形成外、中、内三胚层和体轴。外胚层于d.p.f. 20左右进一步发育形成位于中间的神经板(也称为神经外胚层)、位于两侧的表皮外胚层和位于两者之间的神经板边缘。神经板弯曲、折叠、增厚并进一步闭合,形成神经管。闭合的神经管沿胚胎背腹轴分化出不同的神经祖细胞。神经管形成的过程称为神经胚形成。中、内胚层进一步发育出体节、心脏、肠管等早期器官的原基,胚胎自此进入更加复杂的器官发育阶段。由于人早期胚胎样品极难获取,以上事件在人类胚胎中无法被直接探究和揭示。 胚胎体外培养技术为探究人类胚胎早期发育提供了有力武器。借此,人d.p.f. 14之前的发育事件已被初步揭示1-4。但人类胚胎体外研究存在必须在d.p.f. 14终止的伦理限制。因此,体外培养的人类胚胎不能被用于研究d.p.f. 14之后的原肠运动和早期神经胚发育等事件。非人灵长类与人类在进化上和发育生物学特征上高度相似,是研究人早期胚胎发育的理想模型。因此,搭建非人灵长类胚胎体外培养体系,揭示非人灵长类胚胎发育特征,将极大提升我们对包括人类在内的灵长类早期胚胎发育及相关疾病的认识。1995年,澳大利亚科学家将绒猴的囊胚体外培养至d.p.f. 11,用于研究灵长类动物胚胎植入后发育5。2019年,王红梅团队及国内外同行将食蟹猴胚胎体外培养至d.p.f. 20,探究了灵长类早期原肠运动特征6,7。那么,灵长类胚胎中晚期原肠运动和早期神经胚发育有哪些特征?是否可以延长食蟹猴胚胎体外发育历程,以进一步探究灵长类胚胎发育特征?这些问题一直是发育生物学领域前沿热点问题。 为了回答以上科学问题,研究者建立了一个可支持食蟹猴胚胎体外发育至受精后25天的3D长时程培养体系,并基于该体系探究了灵长类胚胎中晚期原肠运动和早期神经发育过程中的核心事件和谱系特征。研究者比较了人类和非人灵长类胚胎2D(2D Ibidi μ-plates和2D coated with Matrigel, Ibidi-2D和M-2D)和3D(3D low-adhesion 96-well with Matrigel, M-3D)体外培养体系1,6,7,对不同体系中胚胎的大小和存活率进行评估。研究者发现,2D和3D体系都能支持胚胎发育到d.p.f. 20。在2D体系下,胚胎由于胚外组织发育旺盛而迅速增大,但内部的胚体发育并不好。而在3D体系下,胚胎的胚外组织生长受限,但胚体结构显著发育。这些特征提示2D体系优先支持胚外组织生长,而胚外组织的过度生长可能限制了胚体本身的发育。为了保证胚体的发育,研究者继续优化3D体系。已报道的人类胚胎M-3D体系需要在d.p.f. 9-14的培养基中连续添加Matrigel,以模拟人类胚胎植入后环境1。鉴于食蟹猴胚胎植入子宫比人类胚胎浅表,因此,研究者仅在d.p.f. 10-12的培养基中加入Matrigel。优化后的体系能支持33.7%(n = 91)的食蟹猴胚胎发育到d.p.f. 25,该体系被命名为3D长时程培养体系(prolonged in vitro culture,pIVC;图1)。 为了探究灵长类早期神经胚发育过程,研究者首先对神经系统发育关键调控因子进行鉴定。首先,d.p.f. 20-22胚胎的胚体背侧中部可检测到OTX2+/OCT4+或OTX2+/SOX2+的细胞,提示OTX2的表达与外胚层细胞分化密切相关。PAX3和PAX6表达于d.p.f. 22-25的外胚层细胞,表明此时神经外胚层的特化。在d.p.f. 24-25的胚胎中可检测到神经外胚层闭合的区域,提示神经管形成。另外,OTX2、PAX8和NKX2.2阳性细胞分布于神经管的前部、中部和后部,提示此时的胚胎已有前脑、中脑和后脑/脊髓的区域化。结合神经管的形态特征,研究者发现胚胎前部神经管未闭合,后部神经管已闭合。未闭合和已闭合的神经管都表达N-CAD,而不表达E-CAD,表明胚胎在神经管闭合之前已完成E-CAD向N-CAD的转变。这些pIVC胚胎的神经管形态和分子表达特征与体内相同发育阶段的胚胎相似(图2)。伴随神经外胚层的发育,表皮和神经板边缘的发育同步进行。荧光染色结果显示,d.p.f. 22-25的胚胎已分化出TFAP2A+/E-CAD+的表皮细胞。在未闭合的神经板两侧和闭合的神经管两侧存在PAX3+/SOX9+/SLUG+细胞,标志着神经板边缘和其分化的神经嵴细胞的发育。 为了探究闭合的神经管细胞是否具有沿背腹轴不对称分化的模式,研究者对d.p.f. 25胚胎的神经管进行鉴定。发现在闭合的神经管背侧存在PAX3阳性细胞、腹侧存在FOXA2和NKX6.1阳性细胞,表明神经管顶板(roof plate)和底板(floor plate)的特化。此外,β-tubulin Ⅲ+/OLIG2+细胞标志着运动神经元祖细胞(progenitors of motor neurons)的特化;NKX2.2+/FOXA2+细胞标志着腹侧中间神经元祖细胞(progenitors of ventral interneuron 3)的特化。与闭合的神经管相比,OLIG2和NKX2.2未能在未闭合的神经管中检测到。这些分子表达特征与体内对应阶段胚胎的特征一致,表明pIVC胚胎可重现神经管沿背腹轴区域化发育的模式(图3)。 除外胚层和神经管发育外,研究者还检测了pIVC胚胎中原始生殖细胞(primordial germ cells)和中、内胚层的发育特征。荧光染色结果显示,SOX17+/TFAP2C+/BLIMP1+细胞可在d.p.f. 22-24的胚胎后部腹侧被检测到,提示pIVC胚胎可发育出原始生殖细胞样细胞。在胚胎腹侧的位置还可检测到T+/CDX2+/OCT4+/Low或T+/TBX6+/SOX2-细胞,表明pIVC胚胎可发育出原条及其分化产物。此外,T+/TBX6+/SOX2+细胞的出现提示胚体存在类神经中胚层祖细胞(neuromesodermal progenitor)或前体节中胚层细胞(presomitic mesoderm)的特化。另外,研究者可在pIVC胚胎的单细胞转录组数据中检测到MYL7、NKX2-5、HAND1和GATA4共表达的细胞,提示pIVC胚胎或存在心脏中胚层样细胞。单细胞多组学和荧光染色结果提示pIVC胚胎中可检测到OTX2+/FOXA2+/SOX17+细胞,表明胚胎已分化出定型内胚层(definitive endoderm)和卵黄囊(yolk sac)。与相同发育阶段的体内正常胚胎相比,pIVC胚胎的这些分子表达特征与正常胚胎相似,表明pIVC胚胎可重现原肠运动中晚期阶段中胚层和内胚层的发育。 研究者进一步利用单细胞多组学测序技术(单细胞转录组、DNA甲基化和染色质可及性测序,scChaRM-seq)8,对9个pIVC胚胎的3,850个单细胞的转录组和1,862个单细胞的DNA甲基化和染色质可及性进行测序和分析。结果提示,与本团队2022年在Nature杂志报道的相同发育阶段的食蟹猴胚胎单细胞转录组数据库相比9,pIVC胚胎可重现体内正常胚胎的转录组特征。DNA甲基化分析提示,pIVC胚胎各种细胞类型的基因均发生了甲基化,且胚胎组织的DNA甲基化水平(~75%)高于胚外组织(~50%),这与已报道的小鼠和人类胚胎特征相似2,10。 综上所述,本研究建立了可支持食蟹猴胚胎体外发育至d.p.f. 25的3D pIVC体系,基于该体系揭示了灵长类胚胎中晚期原肠运动至早期神经胚发育阶段胚胎的形态、细胞组分、转录组、DNA甲基化和染色质可及性等特征。该研究为深入了解人类早期胚胎发育机制,以及早期胚胎发育异常相关疾病的病理研究提供了技术平台。 本研究工作于2023年5月11日以封面文章形式发表于Cell,题为“Neurulation of the cynomolgus monkey embryo achieved from 3D blastocyst culture”。中国科学院动物研究所、北京干细胞与再生医学研究院王红梅研究员、美国宾夕法尼亚大学Nicolas Plachta教授、中国科学院动物研究所郭帆研究员和李伟研究员为该文共同通讯作者。中国科学院动物研究所副研究员翟晶磊、博士研究生徐艳红、助理研究员万海峰、博士研究生燕蕊、博士研究生郭敬以及美国宾夕法尼亚大学博士后Robin Skory为该文的共同第一作者。 文章链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00415-4 参考文献: 1 Xiang, L. et al. A developmental landscape of 3D-cultured human pre-gastrulation embryos. Nature 577, 537-542, doi:10.1038/s41586-019-1875-y (2020). 2 Zhou, F. et al. Reconstituting the transcriptome and DNA methylome landscapes of human implantation. Nature 572, 660-664, doi:10.1038/s41586-019-1500-0 (2019). 3 Shahbazi, M. N. et al. Self-organization of the human embryo in the absence of maternal tissues. Nat Cell Biol 18, 700-708, doi:10.1038/ncb3347 (2016). 4 Deglincerti, A. et al. Self-organization of the in vitro attached human embryo. Nature 533, 251-254, doi:10.1038/nature17948 (2016). 5 A. Lopata, D. J. K., L.G. Bowes, AND W.B. Watkins. Culture of Marmoset Blastocysts on Matrigel: A Model of Differentiation During the Implantation Period. THE ANATOMICAL RECORD 241, 469-486 (1995). 6 Ma, H. et al. In vitro culture of cynomolgus monkey embryos beyond early gastrulation. Science 366, doi:10.1126/science.aax7890 (2019). 7 Niu, Y. et al. Dissecting primate early post-implantation development using long-term in vitro embryo culture. Science 366, doi:10.1126/science.aaw5754 (2019). 8 Yan, R. et al. Decoding dynamic epigenetic landscapes in human oocytes using single-cell multi-omics sequencing. Cell Stem Cell 28, 1641-1656 e1647, doi:10.1016/j.stem.2021.04.012 (2021). 9 Zhai, J. et al. Primate gastrulation and early organogenesis at single-cell resolution. Nature 612, 732-738, doi:10.1038/s41586-022-05526-y (2022). 10 Argelaguet, R. et al. Multi-omics profiling of mouse gastrulation at single-cell resolution. Nature 576, 487-491, doi:10.1038/s41586-019-1图1. 能够支持食蟹猴胚胎体外发育至d.p.f. 25的3D长时程培养体系图 2. pIVC胚胎神经外胚层和神经嵴的特化图3. pIVC胚胎神经管细胞的特化
2023-05-12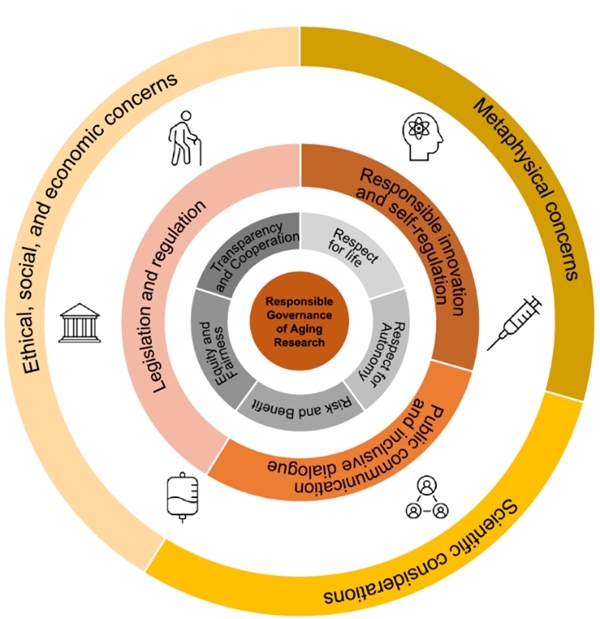
合作发布国际首个衰老研究伦理治理框架
2023年4月27日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组与中国科学院动物研究所、北京干细胞与再生医学研究院“致一”研究员彭耀进合作,在Trends in Molecular Medicine杂志在线发表题为“Acting on ethics and governance of aging research”的政策论文。这是衰老研究团队与科技治理研究团队共同探究前沿科技发展与伦理治理的典范,首次在国际范围内提出针对衰老研究伦理治理框架与策略。 在过去的30年中,衰老研究取得了显著进展,已进入一个独特的新阶段。衰老研究正在从探索衰老的症状发展到揭示衰老表型的潜在机制,并开始深入探究一系列潜在的衰老干预策略,如药物干预、基因治疗、再生医学、免疫干预和主动健康。一些干预措施已经进入临床试验阶段。此外,基因组测序和数据科学等研究工具和方法的发展,推动衰老研究成为生物医学领域的重要焦点之一。人类健康需求与科技融合发展,共同推动着衰老研究新时代的到来。 衰老研究具有巨大潜力,衰老干预技术和产品得到了迅速推进。然而,衰老研究及临床转化也面临诸多紧迫且棘手的社会和伦理问题。如果不能及时妥善解决这些问题,可能导致意想不到的制度和社会后果,从而阻碍衰老研究领域的可持续发展。积极的风险评估、提高透明度及更好的治理框架对于行业的健康发展推进意义重大。 2023年4月27日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组与中国科学院动物研究所、北京干细胞与再生医学研究院“致一”研究员彭耀进合作,在Trends in Molecular Medicine杂志在线发表题为“Acting on ethics and governance of aging research”的政策论文。这是衰老研究团队与科技治理研究团队共同探究前沿科技发展与伦理治理的典范,首次在国际范围内提出针对衰老研究伦理治理框架与策略。 研究人员基于对衰老研究的深入理解,在探索衰老研究的发展需求、内生驱动力及技术趋势的基础上,从三个维度系统阐释重要的伦理和社会问题:衰老研究技术本身、哲学层面的思辨以及特定性的伦理和社会关注。在科学技术层面,尤其是当前衰老研究尚处于早期阶段,如衰老干预的本质、干预的最佳周期、频率和适用性等诸多科学问题还未得到充分解决,这些问题不可避免地会影响伦理和社会考量。不确定性也为相关伦理和社会关注增加了复杂性。在形而上学问题上,诸如延长人类寿命在伦理上是否必要或可接受,干预衰老是否合乎道德,衰老研究是否挑战衰老的必然性等,这些问题因文化、社会和宗教因素而异,争议较大。特定性伦理和社会关注包括老年临床研究参与者的特殊保护、衰老研究技术成果过早商业化以及行业虚假和误导性宣传等问题。同时,衰老干预措施可能产生潜在人口、经济和社会文化影响。 该研究系统性地构建了全球性的衰老研究伦理治理框架,以促进人类健康的发展。首先,研究人员提出将衰老“审视”为一种“疾病”,有助于培养长期的社会发展观,而不仅仅是关注衰老作为生命退化过程的科学观点。基于此理解,该研究建议将尊重生命,尊重自主性、风险与受益的平衡、公平与公正、透明与合作等基本纳入各法域衰老研究治理框架的监管结构和过程。坚持这些原则将有助于降低风险,并促进快速发展的衰老研究领域的潜在效益。在治理框架设计方面,研究人员强调临床转化的长远发展,适当的立法与规制对衰老研究至关重要,科学界和产业界的自我监管与负责任创新也是关键因素。此外,还需要与公众进行良好的沟通与科普。这些方面均是从衰老研究与干预措施应用角度切入,为衰老研究相关伦理和社会问题的防治提供了新的策略,对衰老基础研究和转化医学领域具有重要理论和实践价值。 综上,这项研究关注的是衰老领域中经常被忽视的伦理与社会问题,立足于技术发展前沿,对领域内现存问题及潜在风险进行深入剖析,最终构建一个兼具平衡性、包容性与针对性的,且可以根据各个国家与地区不同情况而进行调整的全球性治理框架。随着新技术的出现,如涉及纳米机器人和增强组织再生的器官修复技术、器官制造和移植,以及遗传和表观遗传学干预,衰老研究相关的伦理和社会考量将变得更为复杂。该研究所构建的治理框架仅是一个开始。基于该框架,研究人员希望能够推动全球衰老研究领域的生物学、医学、法学、伦理学等专家学者,政策制定者、监管者以及公众,足够重视相关问题,并前瞻性思考提前做好应对举措,从而推动衰老研究的高质量、可持续发展,最终惠及人类社会。 通过深入探讨伦理和治理问题,这篇政策论文为衰老科学领域树立了一个伦理治理的典范。在全球范围内,这一伦理治理框架将有助于提高衰老研究的社会认知度,促进多学科、多领域的合作与交流,为应对衰老研究中的伦理与社会挑战、共建人类卫生健康共同体提供支持和保障。 该研究由中国科学院动物研究所、北京干细胞与再生医学研究院、中国科学院干细胞与再生医学创新研究院、北京理工大学、中国衰老标志物研究联合体等合作完成。中国科学院动物研究所/北京干细胞与再生医学研究院研究员宋默识、博士后丁璐璐,北京理工大学肖振宇教授为文章的并列第一作者。中国科学院动物研究所/北京干细胞与再生医学研究院研究员刘光慧、“致一”研究员彭耀进为文章的共同通讯作者。 文章链接:https://www.sciencedirect.com/science/article/pii/S1471491423000643图1:衰老研究的伦理负责任治理框架
2023-05-04
干细胞院合作揭示调控灵长类器官衰老的表观转录组机制
2023年4月6日,中国科学院动物研究所刘光慧研究组、曲静研究组联合中国科学院北京基因组研究所慈维敏研究组以及张维绮研究组在Nature Aging杂志在线发表了题为“m6A epitranscriptomic regulation of tissue homeostasis during primate aging”的研究论文。该研究利用非人灵长类动物(食蟹猴)生理性衰老的多器官研究模型,同时结合基于基因编辑和人类干细胞定向分化的研究体系,通过系统绘制器官和细胞衰老过程中RNA m6A修饰的动态图谱,解析了RNA甲基化修饰及相关基因表达稳态的变化规律,并深入阐释了METTL3–m6A–NPNT通路调控骨骼肌衰老的新型机制。 m6A是目前已知的真核细胞mRNA上最为常见的一类化学修饰,它的建立、读取和擦除分别受到相应甲基化酶(writer)、结合蛋白(reader)以及去甲基化酶(eraser)的动态可逆调控。研究表明,m6A能够通过调节mRNA的剪接、出核、稳定性以及翻译等生命周期活动,参与调控机体的诸多生理或病理进程,包括胚胎发育、肿瘤以及神经退行性疾病的发生等。然而,在生理性衰老过程中,m6A对于器官稳态维持的调控作用以及关键分子机制均有待阐明。 2023年4月6日,中国科学院动物研究所刘光慧研究组、曲静研究组联合中国科学院北京基因组研究所慈维敏研究组以及张维绮研究组在Nature Aging杂志在线发表了题为“m6A epitranscriptomic regulation of tissue homeostasis during primate aging”的研究论文。该研究利用非人灵长类动物(食蟹猴)生理性衰老的多器官研究模型,同时结合基于基因编辑和人类干细胞定向分化的研究体系,通过系统绘制器官和细胞衰老过程中RNA m6A修饰的动态图谱,解析了RNA甲基化修饰及相关基因表达稳态的变化规律,并深入阐释了METTL3–m6A–NPNT通路调控骨骼肌衰老的新型机制。 在这项工作中,研究人员通过对年轻和年老食蟹猴的肝脏、骨骼肌和心脏进行系统的组织学分析发现,脂肪蓄积增加、炎症因子上调以及核纤层蛋白Lamin B1下调是三种组织衰老的共性特征;此外还发现骨骼肌中的凋亡细胞增加、肌纤维萎缩、以及心脏中的心肌纤维肥大等组织特异的衰老相关退行性变化。随后,通过联合分析三种组织的m6A表观修饰图谱及相应的转录组图谱,研究人员揭示了m6A修饰和基因表达稳态之间的相关性以及不同组织共性和特性的衰老调控规律。相较于肝脏和心脏,研究人员在骨骼肌中特异性地检测到了整体m6A修饰的减少以及核心甲基化酶METTL3表达水平的降低。进而通过CRIPSR/Cas9技术,研究人员建立了由人类胚胎干细胞衍生的METTL3敲除的肌管细胞,发现METTL3的缺失导致肌管细胞发生萎缩、凋亡以及加速衰老等退行性变化,与衰老骨骼肌的表型一致。进一步的机制研究揭示了NPNT作为METTL3的下游效应因子发挥维持骨骼肌细胞稳态的作用,而慢病毒载体介导的METTL3或NPNT回补表达均能一定程度上延缓人类肌管细胞的衰老。最后,通过METTL3酶活抑制剂处理以及METTL3酶活突变体过表达等相关实验,研究人员证实了METTL3通过m6A催化活性依赖的方式促进NPNT的表达以及维持肌管细胞的稳态,并且发现m6A结合蛋白IGF2BP1可以结合并稳定受到m6A修饰的NPNT mRNA。 综上所述,该研究系统揭示了三种重要的灵长类器官/组织在生理性衰老过程中的动态m6A修饰变化及其与基因表达稳态的关系,并且深入阐明了METTL3–m6A–NPNT通路维持人类骨骼肌稳态的作用和机制。研究深化了人们对m6A参与维持人类器官功能稳态的认识以及对衰老的表观转录调控机理的理解,为研究骨骼肌衰老提供了一个有效整合灵长类器官模型和人类干细胞衍生物体系的系统性平台,同时也为延缓骨骼肌衰老或治疗与年龄相关的骨骼肌退行疾病(如肌少症)提供了潜在的分子靶标和干预策略。 该工作由中国科学院动物研究所、中国科学院北京基因组研究所(国家生物信息中心)、中国科学院干细胞与再生医学创新研究院、首都医科大学宣武医院等多家机构合作完成。中国科学院动物研究所刘光慧研究员、中国科学院北京基因组研究所慈维敏研究员和张维绮研究员、以及中国科学院动物研究所曲静研究员为文章的共同通讯作者。中国科学院动物研究所特别研究助理武泽明、中国科学院北京基因组研究所博士研究生路明明、中国科学院动物研究所硕士研究生刘迪、中国科学院北京基因组研究所史悦副研究员、任捷研究员以及首都医科大学宣武医院王思研究员为文章的并列第一作者。该研究同时得到了中国科学院北京基因组研究所杨运桂研究员、肖景发研究员以及中国科学院动物研究所魏妥研究员的合作与支持,并获得了国家科技部、国家自然科学基金委和中国科学院等项目的大力资助。 原文链接:https://doi.org/10.1038/s43587-023-00393-2图1:METTL3-m6A-NPNT通路调控灵长类骨骼肌衰老图2. METTL3通过RNA m6A修饰调控衰老
2023-04-10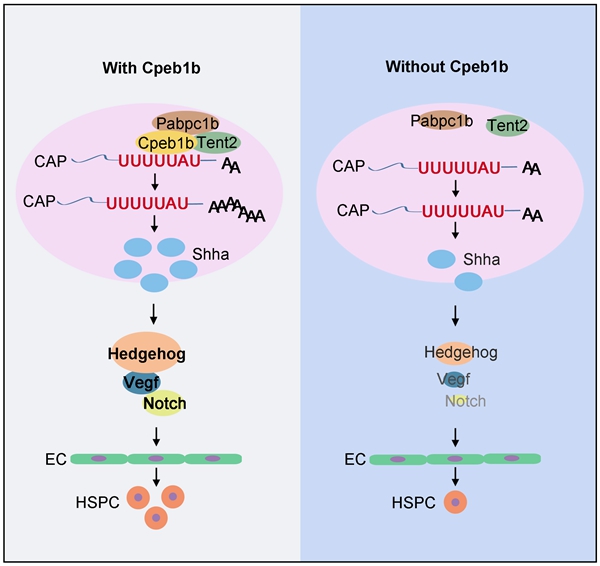
刘峰研究组合作研究阐明胞质内多聚腺苷酸化调控造血干祖细胞发育的机制
近日,中国科学院动物研究所、干细胞与再生医学研究院刘峰研究组和中国科学院北京基因组研究所杨运桂课题组合作在PNAS杂志上发表了题为 “Cpeb1b-mediated cytoplasmic polyadenylation of shha mRNA modulates zebrafish definitive hematopoiesis” 的研究论文,揭示了胞质多聚腺苷酸化调控斑马鱼HSPC发育的机制。 在脊椎动物胚胎发育过程中,次级造血(definitive hematopoiesis)过程可以产生造血干祖细胞(hematopoietic stem and progenitor cell, HSPC), 而HSPC具有产生所有谱系的血细胞和维持机体终生血液系统的能力 [1]。在次级造血时期,哺乳动物主动脉-性腺-中肾区或斑马鱼背主动脉腹侧壁区域中的一部分内皮细胞接受细胞内、外信号,获得造血潜能,成为生血内皮细胞。这些生血内皮细胞逐渐改变自身形态,由扁平变为球形,并从背主动脉脱离出来最终转变为HSPC [1]。但是,这些内皮细胞如何被精确调控以进行内皮-造血的命运转变仍未完全探究清楚。 转录后调控,包括选择性剪接 [2]、RNA修饰 [3]、miRNA调节 [4] 以及RNA二级结构 [5, 6] 等,通过控制RNA分子代谢,在信号通路精确调控及细胞命运决定中起着至关重要的作用。胞质多聚腺苷酸化作为转录后调控之一,主要由CPEB家族蛋白调控。CPEB特异性地与靶mRNA的3′非翻译区(3' untranslated region, UTR)富含U的胞质多聚腺苷酸化元件(cytoplasmic polyadenylation element, CPE)结合,并通过组装胞质加尾复合物来促进多聚腺苷酸化和翻译起始 [7]。CPEB家族蛋白参与多种生物学过程的调控,包括突触可塑性、生殖细胞特化、细胞衰老和肌肉干细胞激活等 [8]。据血液疾病相关研究报道,CPEB1在多发性骨髓瘤细胞中的表达显著降低,提示其可能与骨髓瘤的进展有关 [9]。此外,在霍奇金淋巴瘤来源的细胞系中,CPEB1介导的多聚腺苷酸化参与了恶性肿瘤相关基因的调控 [10]。然而,CPEB家族蛋白和胞质多聚腺苷酸化是否在脊椎动物HSPC发育过程中发挥作用尚不清楚。 近日,中国科学院动物研究所、干细胞与再生医学研究院刘峰研究组和中国科学院北京基因组研究所杨运桂课题组合作在PNAS杂志上发表了题为 “Cpeb1b-mediated cytoplasmic polyadenylation of shha mRNA modulates zebrafish definitive hematopoiesis” 的研究论文,揭示了胞质多聚腺苷酸化调控斑马鱼HSPC发育的机制。 该研究团队发现在斑马鱼胚胎发育过程中cpeb1b在脊索区域高表达,双荧光原位杂交显示其与脊索特异性表达基因shha具有共定位。随后一系列表型分析实验显示Cpeb1b缺失导致次级造血过程中HSPC的产生减少,并且HSPC减少是由生血内皮细胞特化缺陷导致。为了进一步研究Cpeb1b的造血调控机制,团队收集了不同发育时期的野生型和cpeb1b突变体胚胎进行RNA-seq分析。GO (gene ontology)分析显示在Cpeb1b缺陷胚胎中,已知参与HSPC发育调控的关键信号通路Hedgehog发生了下调。结合后续生化分析,证实了Cpeb1b缺陷导致Hedgehog通路活性抑制,并进一步导致Hedgehog-Vegf-Notch 信号轴下调,最终造成HSPC的产生减少。 团队进一步通过组学及生化实验研究该表型的分子机制。RNA immunoprecipitation (RIP)-seq和RIP-qPCR实验结果显示Cpeb1b结合Hedgehog通路关键配体shha的mRNA。序列分析显示,shha mRNA的3' UTR含有经典的CPE motif。通过凝胶电泳阻滞试验(electrophoretic mobility shift assay, EMSA)及体外/体内的CPE motif探针pull-down实验发现,Cpeb1b能结合野生型CPE motif探针而非motif序列突变的探针,证明了Cpeb1b与shha mRNA的特异性相互作用依赖于CPE motif。 通过观察荧光标记的Cpeb1b、shha mRNA和非典型poly(A)聚合酶Tent2亚细胞定位发现,这些分子共同形成胞质内的凝聚物,并且不同凝聚物可以发生融合。光漂白恢复(fluorescence recovery after photobleaching, FRAP)实验显示这些凝聚物中的分子可以扩散并与周围的溶液进行交换,进一步证明了凝聚物的类液体特性,团队因此推测此凝聚物由液-液相分离(liquid-liquid phase separation, LLPS)产生。后续分析发现,虽然Cpeb1b自身无法发生相分离,但此凝聚物中含有能发生相分离的Pabpc1b蛋白,Cpeb1b可以通过促进Pabpc1b蛋白相分离来形成大量凝聚物。然而,此凝聚现象的具体作用和详细分子机制还有待进一步阐明。 团队提取了细胞质RNA作为材料并通过PAT (PCR poly(A) test)实验探究Cpeb1b是否调控早期发育过程中胞质内shha mRNA的多聚腺苷酸化。结果显示与野生型相比,cpeb1b突变体中shha mRNA的poly(A)长度明显更短;作为对照的非Cpeb1b靶标rps18 mRNA的poly(A)长度在野生型和突变体组之间没有差异。由此证明,Cpeb1b参与调控shha mRNA的胞质多聚腺苷酸化。通过核糖体图谱分析(ribosome profiling)发现,与野生型相比,cpeb1b突变体中shha mRNA的翻译效率更低。蛋白印迹分析显示cpeb1b突变体中Shha蛋白水平也出现下降。因此,Cpeb1b通过多聚腺苷酸化来调控shha mRNA的翻译效率。 综上所述,该研究发现在斑马鱼早期胚胎发育过程中,Cpeb1b介导的shha mRNA胞质多聚腺苷酸化能增强其翻译效率,从而提高Shha蛋白水平。Shha蛋白通过激活Hedgehog-Vegf-Notch信号轴来促进生血内皮细胞的特化,进而维持正常的HSPC产生过程。这些发现为解析信号通路如何被精确调控并指导内皮细胞进行内皮-造血的命运转变提供新的线索。 该研究由中国科学院动物研究所刘峰研究组和中国科学院北京基因组研究所杨运桂课题组合作完成,西南大学罗凌飞教授和中国医学科学院天津血液所王璐研究员给予重要指导和帮助。该研究得到科技部国家重点研发计划、国家自然科学基金委重点项目以及中国科学院先导专项的资助。 原文链接:https://www.pnas.org/doi/10.1073/pnas.2212212120 参考文献: [1] ORKIN S H, ZON L I. Hematopoiesis: an evolving paradigm for stem cell biology [J]. Cell, 2008, 132(4): 631-44. [2] KOMENO Y, HUANG Y J, QIU J, et al. SRSF2 Is Essential for Hematopoiesis, and Its Myelodysplastic Syndrome-Related Mutations Dysregulate Alternative Pre-mRNA Splicing [J]. Mol Cell Biol, 2015, 35(17): 3071-82. [3] ZHANG C, CHEN Y, SUN B, et al. m(6)A modulates haematopoietic stem and progenitor cell specification [J]. Nature, 2017, 549(7671): 273-6. [4] LU X, LI X, HE Q, et al. miR-142-3p regulates the formation and differentiation of hematopoietic stem cells in vertebrates [J]. Cell Res, 2013, 23(12): 1356-68. [5] SHI B, ZHANG J, HENG J, et al. RNA structural dynamics regulate early embryogenesis through controlling transcriptome fate and function [J]. Genome Biol, 2020, 21(1): 120. [6] SHI B, HENG J, ZHOU J Y, et al. Phase separation of Ddx3xb helicase regulates maternal-to-zygotic transition in zebrafish [J]. Cell Res, 2022, 32(8): 715-28. [7] RICHTER J D. CPEB: a life in translation [J]. Trends Biochem Sci, 2007, 32(6): 279-85. [8] ZENG W, YUE L, LAM K S W, et al. CPEB1 directs muscle stem cell activation by reprogramming the translational landscape [J]. Nat Commun, 2022, 13(1): 947. [9] HELLER G, SCHMIDT W M, ZIEGLER B, et al. Genome-wide transcriptional response to 5-aza-2'-deoxycytidine and trichostatin a in multiple myeloma cells [J]. Cancer Res, 2008, 68(1): 44-54. [10] BAVA F A, ELISCOVICH C, FERREIRA P G, et al. CPEB1 coordinates alternative 3'-UTR formation with translational regulation [J]. Nature, 2013, 495(7439): 121-5.图1 文章标题图2 Cpeb1b介导的shha mRNA胞质多聚腺苷酸化调控斑马鱼HSPC发育的机制示意图
2023-02-08
干细胞院合作揭示人类基因组古病毒复活驱动衰老
2023年1月6日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组和中国科学院北京基因组研究所张维绮课题组合作在Cell杂志在线发表题为Resurrection of endogenous retroviruses during aging reinforces senescence的研究论文。该研究首次发现了年轻的ERV亚家族在细胞衰老过程中被再度唤醒,提出了古病毒复活介导衰老程序化及传染性的理论,并且创新性地发展出阻断ERV古病毒复活及扩散以实现延缓衰老的多维干预策略。 病毒与人类之间的协同进化关系源远流长,它们之间的交锋从未随时间停止过。在这场旷日持久的战争中,一方面,病毒使人类饱受疾病困扰,甚至死亡,并在此过程中对人类基因组不断地利用与改造;另一方面,人类的免疫系统会积极对抗病毒的入侵,使得整合到人类基因组中的病毒序列逐渐被宿主细胞的遗传调控系统接管,协同进化。内源性逆转录病毒(Endogenous Retrovirus, ERV)是数百万年前远古逆转录病毒入侵整合到人类基因组的遗迹——“古病毒化石”。在漫长的岁月中,大量ERV的遗传信息被人类细胞俘获,并经过突变、缺失等变异成为人类基因组中的“暗物质”潜伏下来,占据了人类基因组序列的8%左右,成为重要的基因记忆。人类与ERV可谓“魔高一尺道高一丈”,然而在生命的孕育及演化中又貌似呈现出和谐共生的景象。 衰老是人类慢性疾病的最大危险因素。细胞衰老是机体衰老及各种衰老相关疾病发生发展的重要诱因,表观遗传的程序化改变被认为是决定细胞衰老进程的关键因素。人类基因组潜藏着诸多“老化”信号,这些衰老信息流通常受到表观遗传的严密调控而处于沉默状态,但在增龄过程中,由于表观遗传的失序,这些“老化”信号逃离管控,进而激活启动细胞内的一系列衰老程序。然而,占据人类基因组序列较大比例、如“死火山”般沉寂的ERV古病毒元件是否参与了衰老的程序化调控尚且未知。沉睡在人类基因组中的ERV元件能否在衰老过程中逃脱宿主的监视而被再度唤醒?这些“死火山”的苏醒与爆发对细胞和组织的衰老有何影响?ERV古病毒的复活能否作为度量人类生物学年龄的标志物以及干预衰老的分子靶标?这些关键科学问题亟待解决。 2023年1月6日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组和中国科学院北京基因组研究所张维绮课题组合作在Cell杂志在线发表题为Resurrection of endogenous retroviruses during aging reinforces senescence的研究论文。该研究首次发现了年轻的ERV亚家族在细胞衰老过程中被再度唤醒,提出了古病毒复活介导衰老程序化及传染性的理论,并且创新性地发展出阻断ERV古病毒复活及扩散以实现延缓衰老的多维干预策略。 研究人员利用团队建立的不同衰老研究体系(包括儿童早衰综合征、成年早衰综合征、复制性衰老、生理性衰老的人间充质干细胞模型,人成纤维细胞衰老模型,以及小鼠、猴和人的生理性及病理性多器官衰老模型),结合高通量链特异性转录本测序、全基因组DNA甲基化测序、高分辨率单分子RNA/DNA原位杂交、免疫电镜和高灵敏的液滴数字PCR等多学科交叉技术,发现衰老细胞中表观遗传去抑制(如异染色质减少)导致基因组中ERV的转录激活并翻译出病毒蛋白,进而包装成为病毒颗粒。一方面,衰老细胞中ERV的反转录产物通过激活cGAS-STING天然免疫通路诱发细胞衰老和炎症;另一方面,衰老细胞释放的ERV病毒颗粒可通过旁分泌或体液介导的方式在器官、组织、细胞间有效传递并放大衰老信号,最终使得年轻细胞因受“感染”而老化。深入的机制研究表明,ERV反转录产物在宿主细胞胞浆中的出现,会激活初始细胞及被感染细胞中固有的病毒防御机制。这种本能的细胞抗病毒反应意在降低病毒的损害,然而事与愿违,这些防御性机制却恰恰促进了细胞的早衰。研究人员详细阐释了衰老细胞基因组中ERV古病毒程序性复活、触发细胞老化、借助病毒颗粒传递衰老信号、感染年轻细胞的全链条机制。进一步,通过对ERV古病毒潜伏、复活、细胞间传递等不同生命周期环节的解析,研究人员开发出有效抑制ERV古病毒复活及清除病毒颗粒的干预策略,即通过发展基于靶向ERV调控元件的CRISPR基因沉默体系、靶向逆转录酶的小分子抑制药物、靶向病毒包膜蛋白的中和抗体等技术,阻断ERV的转录、反转录、病毒级联感染等多个环节,进而实现了组织和机体衰老的延缓。 该研究系统定义并揭示了衰老诱导的内源性逆转录病毒复活(aging-induced resurrection of endogenous retrovirus, AIR-ERV)可以作为细胞、器官乃至机体衰老的驱动力及度量标志物,为衰老的程序化、级联放大和可干预性提供了全新的理论依据,为人类衰老的科学评估和预警、衰老及衰老相关疾病的防治提供了重要的线索和思路。在理论方面,研究创造性地提出了衰老的程序化、跨细胞传递及可干预性,将ERV古病毒的复活确证为新的衰老时钟和驱动因素;在技术方面,研究综合运用多维表观基因组、转录靶向操控、单分子成像、病毒学、免疫学、化学生物学和分子病理学等前沿交叉技术动态捕获了ERV古病毒的复活、包装、颗粒化、跨细胞传递和激活天然免疫通路等多个生物学过程,成功刻画了ERV在衰老机体中的生命周期轨迹,开创了新的衰老研究范式;在转化医学方面,研究以ERV古病毒复活链条的不同环节为靶标发展出多样化的衰老干预技术,为衰老相关疾病的防治提供了新的策略,对衰老转化医学领域具有潜在的应用价值。 综上,该研究提示病毒密码在远古时代便已融入人类的衰老及寿命调控程序,解码基因组中的古病毒元素将有助于深刻理解人类衰老的机制、健康长寿的规律以及多种老年疾病的诱因。ERV古病毒的复活或许为认识衰老的“潘多拉魔盒”提供了一条崭新的路径。“魔盒”的开启为理解衰老规律开辟了新的科学疆域,更为防治老年疾病带来新的希望。未来围绕着衰老伴随的ERV古病毒激活,将会涌现出更多的科学问题,例如:ERV反转录本是否可以重新整合入宿主基因组,进而介导衰老相关的基因组不稳定性?ERV古病毒序列在人类基因组中是否具有遗传多态性?是否与老年健康密切相关?ERV的复活和感染效率是否具有组织和细胞类型特异性?ERV激活是否会选择性驱动特定衰老相关疾病的发生?体液中ERV检测能否应用于衰老和老年疾病的评估和预警?针对ERV生命周期的哪些靶向策略对于临床的衰老和疾病干预最为有效?期待在科学研究不断深入和技术手段日益革新的将来,这些谜题可得以逐一解决。 该研究由中国科学院动物研究所、中国科学院北京基因组研究所、中国科学院遗传与发育研究所、北京干细胞与再生医学研究院、首都医科大学宣武医院、昆明理工大学、华中农业大学、北京大学和北京医院等多家机构合作完成。中国科学院动物研究所刘光慧研究员、曲静研究员及中国科学院北京基因组研究所张维绮研究员为文章的共同通讯作者。中国科学院动物研究所助理研究员刘晓倩、博士研究生刘尊鹏、特别研究助理武泽明和中国科学院北京基因组研究所研究员任捷为文章的并列第一作者。研究得到周琪院士、季维智院士、曹罡教授、牛昱宇教授、汤富酬教授、孙亮教授、王思研究员、张勇研究员、宋默识研究员、陆发隆研究员和郑爱华研究员的合作与支持,同时获得科技部、国家自然科学基金委、中国科学院和北京市等项目的资助。 原文链接:https://doi.org/10.1016/j.cell.2022.12.017图1. HERVK 病毒RNA (左图) 和病毒颗粒(RVLP,右图) 在衰老人类细胞中聚集图2. 内源性古病毒复活驱动衰老的机制与干预策略图3. 内源性古病毒复活驱动开启衰老“潘多拉魔盒”
2023-01-07
