
科学研究
科研进展

郭帆/王红梅团队解析小鼠早期胚胎和生殖细胞发育过程中DNA羟甲基化概观及其调控
2022年12月20日,中国科学院动物研究所、北京干细胞与再生医学研究院郭帆和王红梅团队合作(中国科学院动物研究所博士生燕蕊、联合培养研究生程馨、博士生徐艳红、博士生龙鑫和北京昌平实验室副研究员古婵为本文共同第一作者),在Nature Genetics发表了题为Dynamics of DNA hydroxymethylation and methylation during mouse embryonic and germline development的研究论文。研究者对小鼠配子、受精后的着床前胚胎、着床后胚胎和原始生殖细胞以及体外培养胚胎进行了全基因组5hmC的测序分析,通过分离受精卵中的雌雄原核,定量解析了Tet3和DNA复制对于5hmC产生的影响。此外,研究者通过追踪父母本基因组,进一步揭示了父本和母本基因组之间在5hmC的产生以及分布上的异同。更进一步,研究者还发现了一个影响早期胚胎DNA甲基化重编程和5hmC累积的新因子,并利用敲除小鼠模型结合化学小分子抑制剂进行了深入解析,为胚胎和生殖细胞发育过程中5hmC的调控和功能提供了新的机制见解。
2022-12-20
长期以来,DNA甲基化(5mC)作为哺乳动物中最为经典的DNA共价修饰被广泛研究,其对基因表达调控、转座子沉默、基因印记以及X染色体失活等生命过程至关重要。直到2009年,Anjana Rao实验室在Science首次报道了在哺乳动物细胞中,存在由一类DNA双加氧酶Tet1/2/3介导的基于5mC氧化而产生的新的DNA共价修饰——DNA羟甲基化(5hmC)1;随后,关于5hmC的生物学功能及其意义成为表观遗传学领域有待回答的重大科学问题之一。经过领域内十余年的研究,目前关于5hmC的生物学功能主要存在两种观点:一是5hmC会介导DNA的主动去甲基化,从而产生新的未经修饰的胞嘧啶。体外支持证据来自2011年徐国良教授和张毅教授实验室分别背靠背发表于Science上的研究论文2,3;体内支持证据则是领域内代表性的几个实验室各自独立发现Tet蛋白介导的5mC氧化参与小鼠受精卵和原始生殖细胞(PGC)中DNA甲基化的擦除4。二是5hmC自身也可以介导特定蛋白与DNA的结合或者去结合,例如转录因子或者甲基化CpG结合蛋白等,从而参与调控基因的表达。代表性证据最早来自于Michiel Vermeulen实验室2013年发表在Cell的研究论文,通过定量质谱的蛋白质组学技术在小鼠胚胎干细胞(mESC)、神经元祖细胞(NPC)和成年小鼠脑组织中鉴定出了与5hmC结合或亲和结合5mC的特定蛋白5。
通过定量质谱以及全基因组5hmC测序,人们鉴定出了在胚胎干细胞、神经元祖细胞和成年脑组织中5hmC的水平以及基因组分布6,为研究5hmC的生物学功能迈出了关键的一步。近年来,对于DNA甲基化以及部分组蛋白修饰在早期胚胎中的分布与作用已有连续报道7,使得人们对于早期胚胎发育过程中的关键事件如合子基因组激活和全能性的建立获得了新的认知。然而,关于5hmC在胚胎发育中的功能,过去的研究手段局限于细胞免疫荧光染色,缺乏对该修饰在基因组中分布的细节刻画,使得对于胚胎中5hmC的产生以及作用仍存在较大争议。备受关注的争论之一是受精卵中产生的5hmC是发生在DNA去甲基化区域,还是从头或维持DNA甲基化产生的区域(Rachel Amouroux, et al., Nat. Cell. Biol., 2016)8;其次,尽管5hmC信号在着床前胚胎中会伴随着DNA的复制而被逐步稀释,是否仍有稳定的5hmC位点存在?其在基因组上的分布与基因表达的关系如何?最后,虽然已知Tet3蛋白介导受精卵中5hmC的产生,其它影响DNA甲基化重编程和5hmC累积的因子仍知之甚少。这些问题不仅限制了人们对5hmC在发育过程中功能机制的研究,也影响着DNA甲基化重编程如何发生——这一表观遗传学领域根本问题的结论。
2022年12月20日,中国科学院动物研究所、北京干细胞与再生医学研究院郭帆和王红梅团队合作(中国科学院动物研究所博士生燕蕊、联合培养研究生程馨、博士生徐艳红、博士生龙鑫和北京昌平实验室副研究员古婵为本文共同第一作者),在Nature Genetics发表了题为Dynamics of DNA hydroxymethylation and methylation during mouse embryonic and germline development的研究论文。研究者对小鼠配子、受精后的着床前胚胎、着床后胚胎和原始生殖细胞以及体外培养胚胎进行了全基因组5hmC的测序分析,通过分离受精卵中的雌雄原核,定量解析了Tet3和DNA复制对于5hmC产生的影响。此外,研究者通过追踪父母本基因组,进一步揭示了父本和母本基因组之间在5hmC的产生以及分布上的异同。更进一步,研究者还发现了一个影响早期胚胎DNA甲基化重编程和5hmC累积的新因子,并利用敲除小鼠模型结合化学小分子抑制剂进行了深入解析,为胚胎和生殖细胞发育过程中5hmC的调控和功能提供了新的机制见解。
研究者发现在早期胚胎及生殖细胞发育过程中会经历两次全基因组范围5hmC的产生(图1),第一次发生于受精卵中,偏好性的累积在父本基因组上,并持续到二细胞期而在随后的卵裂过程中被逐渐稀释,直至囊胚期到达最低点;第二次发生于着床后E6.5天胚胎的上胚层细胞(epiblast)中,对称产生在父母本基因组中,在E9.5天的PGC中仍维持较高水平,而在随后阶段逐渐降低直至E13.5天达至最低点。其中,受精卵中产生的5hmC会富集在发生DNA去甲基化的位点,而不是维持性DNA甲基化或从头甲基化位点,这为5hmC可作为去甲基化的中间物提供了最为直接的体内证据。着床后胚胎中产生的5hmC则会定位于发生从头DNA甲基化的位点,高度富集于增强子(enhancer)中,在PGC发生DNA去甲基化时逐渐减少。虽然Tet3主导了受精卵中5hmC的产生,DNA复制也会影响5hmC的生成,尤其是母本基因组受DNA复制的影响更高。生殖细胞中建立的DNA甲基化印记位点会在着床前胚胎中继续维持,而在PGC阶段发生甲基化擦除。研究者发现这些印记位点在epiblast或PGC中会有较高水平的5hmC,令人意外的是在受精卵中印记位点上也有显著水平的5hmC产生。受精后产生的5hmC是否存在可以稳定维持的位点?研究者发现绝大部分位点会伴随着胚胎发育进程而逐渐丢失5hmC,然而仍有极少数位点可以维持显著水平的5hmC直至囊胚期;这些位点对应的基因在母本基因组中从卵细胞开始一直表达,而在父本基因组中则是从二细胞起始表达。
5hmC除了可以介导DNA去甲基化,是否还有其它作用?研究者发现受精后父本基因组产生的5hmC区域与合子基因组激活基因高度重合,分布于基因的启动子(promoter)、增强子和基因体(gene body)中。特定转录因子结合位点也显示出5hmC的富集(图2),Zfp57、Arntl和Ehf结合位点在卵母细胞和着床前胚胎的父母本基因组中有5hmC的富集。其中,Zfp57已被报道在小鼠早期胚胎中将DNMTs招募到其目标位点,参与印记基因甲基化的维持。Runx2, Nfil3, Thrb, Ebf1和Atf1/2结合位点在着床前胚胎的父本基因组中显著富集5hmC。参与小鼠原肠胚形成或早期胚胎器官发生的转录因子如Otx2、T、Pou5f1、Nanog、Sox2、Zic2/3和Myc在E6.5天胚胎的epiblast中也显示出其结合位点富含5hmC。生殖细胞特异的转录因子如Prdm14、Zfx、Zbtb33、Prdm9和Tcf21,其结合位点在PGC中也高度富集5hmC,这些因子已被报道在生殖细胞发育或减数分裂中发挥重要作用。进一步地,研究者分析了5hmC与特定组蛋白修饰之间的关联(图2)。受精之后,H3K4me3和H3K36me3修饰区域会富集5hmC,而H3K9me3和H3K27me3修饰位点通常会排斥5hmC的产生。卵母细胞中H3K9me2修饰区域通常与DNA高甲基化区域在空间上分离,并且从免疫荧光染色的结果推断,受精后母本基因组中H3K9me2修饰会抵抗5hmC的产生。研究者发现卵母细胞中H3K9me2修饰区域在受精后的确会排斥5hmC的产生,但仍有极少数位点会含有较高水平的5hmC。
小鼠体外培养胚胎(IVC embryos)是研究胚胎着床后形态发生和分子事件的替代模型9,其基因组中5hmC的产生与分布跟体内发育胚胎相比有何差异?研究者发现IVC胚胎总体上可以正常发生从头DNA甲基化以及基因组范围5hmC的生成,然而在一些高度富集5hmC且与胚胎形态发生和细胞分化相关联的基因位点,IVC胚胎则显示出5hmC产生不足并有着更高水平的DNA甲基化,相关基因的表达也会显著降低(图3)。这些结果表明,5hmC参与调控了E6.5天epiblast中相应基因的表达,并且IVC胚胎中特定基因位点5hmC水平降低可能与其体外发育受限相关。
除了Tet蛋白,还有哪些因子可能会影响早期胚胎中5hmC的产生和累积?在人类中,多位点印记基因疾病(MLID)与NLRP家族基因的母源突变以及DNA甲基化异常相关10。大多数人类NLRP基因在小鼠中也具有同源基因,并且Nlrp基因敲除的雌鼠通常显示出受精后着床前胚胎发育阻滞,导致不育或生育力降低。有趣的是,Nlrp KO雄鼠生育力则不受影响。研究者根据这些现象提出了一个问题,即母源缺失Nlrp是否会影响早期胚胎的DNA甲基化重编程。然而,关于NLRP基因与异常DNA甲基化之间关联的机制却鲜有文献报道,特别是在通过利用母源缺失Nlrp的小鼠来追踪异常DNA甲基化的起源方面。研究者首先系统分析了小鼠从卵细胞至早期胚胎中所有Nlrp基因的表达,发现除了已被报道的Nlrp5外,Nlrp14也高表达于卵细胞中并呈现出明显的母源表达模式。利用Nlrp14 KO的小鼠模型,研究者进行了更加深入的分析(图4)。同Nlrp5 KO小鼠类似,Nlrp14 KO雄鼠可正常生育,而KO雌鼠受精后表现为着床前胚胎发育阻滞,导致雌性不育。更进一步,研究者发现母源缺失Nlrp14的受精卵中维持性DNA甲基化酶Dnmt1及其辅因子Uhrf1会由细胞质定位转变为细胞核定位,阻碍了DNA复制关联的DNA被动去甲基化的发生,导致父本基因组DNA甲基化水平显著高于正常胚胎。此外,Nlrp14母源KO的胚胎还表现出全基因组染色质开放程度显著降低以及合子基因组激活受阻。受精卵中因Nlrp14缺失使得Dnmt1的活性增强,对5hmC的产生会有怎样的影响?研究者发现Nlrp14缺失的早期胚胎中5hmC水平显著降低,尤其是在原本会发生DNA去甲基化的区域。这一实验证据也再次表明Tet3介导的5hmC产生与DNA去甲基化紧密关联,而不是偏好性地发生在维持性DNA甲基化区域。
最后,研究者继续探索了Nlrp14是否会影响PGC中DNA甲基化重编程以及配子中DNA甲基化的建立。研究者发现Nlrp14 KO的胚胎中,PGC的发育正常且相关特征基因的表达也不受影响。同时,Nlrp14 KO的PGC中全基因组DNA甲基化的擦除亦无异常。在Nlrp14 KO后,精子和卵细胞也可以正常建立DNA甲基化,并且精子和卵子发生均无明显异常。这些结果共同表明Nlrp特异性地参与了受精卵中DNA甲基化重编程并影响Tet3介导的5hmC产生。
综上,该研究系统性地揭示了从小鼠早期胚胎发育至生殖细胞发生过程中5hmC的全基因组分布与分子调控特征,提出了早期胚胎DNA甲基化重编程的新模式(图5)。该研究不仅为表观遗传领域长期以来的重大争议问题提供了有力的实验论证,也为深入理解早期胚胎发育过程中的表观遗传调控开启了新维度。
文章链接:https://www.nature.com/articles/s41588-022-01258-x
参考文献
1. Tahiliani, M. et al. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science 324, 930-5 (2009).
2. Ito, S. et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science 333, 1300-3 (2011).
3. He, Y.F. et al. Tet-mediated formation of 5-carboxylcytosine and its excision by TDG in mammalian DNA. Science 333, 1303-7 (2011).
4. Wu, X. & Zhang, Y. TET-mediated active DNA demethylation: mechanism, function and beyond. Nat Rev Genet 18, 517-534 (2017).
5. Spruijt, C.G. et al. Dynamic readers for 5-(hydroxy)methylcytosine and its oxidized derivatives. Cell 152, 1146-59 (2013).
6. Wu, H. & Zhang, Y. Charting oxidized methylcytosines at base resolution. Nat Struct Mol Biol 22, 656-61 (2015).
7. Du, Z., Zhang, K. & Xie, W. Epigenetic Reprogramming in Early Animal Development. Cold Spring Harb Perspect Biol 14(2022).
8. Amouroux, R. et al. De novo DNA methylation drives 5hmC accumulation in mouse zygotes. Nat Cell Biol 18, 225-233 (2016).
9. Shahbazi, M.N., Siggia, E.D. & Zernicka-Goetz, M. Self-organization of stem cells into embryos: A window on early mammalian development. Science 364, 948-951 (2019).
10. Begemann, M. et al. Maternal variants in NLRP and other maternal effect proteins are associated with multilocus imprinting disturbance in offspring. J Med Genet 55, 497-504 (2018).
图1. 小鼠早期胚胎及生殖细胞中5hmC概观
图2. 特定转录因子和组蛋白修饰与5hmC的关联
图3. IVC胚胎与体内发育胚胎的5hmC水平比较
图4. Nlrp14参与早期胚胎DNA甲基化重编程并影响5hmC的累积
图5. 早期胚胎中5hmC产生以及DNA甲基化重编程模式
王红梅/郭帆/吴军/蒋祥祥团队绘制灵长类胚胎原肠运动至早期器官发育转录组图谱
2022年12月14日,中国科学院动物研究所、北京干细胞与再生医学研究院王红梅和郭帆团队、美国德克萨斯大学西南医学中心吴军团队以及安徽医科大学蒋祥祥团队合作(中国科学院动物研究所博士后翟晶磊、博士生郭敬、助理研究员万海峰、博士生齐鲁青和德克萨斯大学西南医学中心的博士后刘立中为本文共同第一作者)在Nature上发表了文章Primate gastrulation and early organogenesis at single-cell resolution[7]。研究者以食蟹猴为模型,利用单细胞转录组测序和干细胞分化模型等,绘制了食蟹猴CS8-CS11时期(E20-E29)胚胎的单细胞转录组图谱,揭示了原肠运动和三胚层分化(神经管、体节、肠管等的发育)过程中重要细胞类群的特征及其谱系发生和调控机制,并比较了啮齿类和灵长类早期胚胎发育事件的进化差异。
2022-12-14
人的生命开始于精子与卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵经历卵裂形成囊胚,囊胚在E7左右种植到母体子宫进一步发育。E14开始,胚胎经历原肠运动,胚胎后部细胞发生大规模定向迁移,并形成原条细胞。原条细胞进一步分化为中胚层和定型内胚层(definitive endoderm),同时胚胎前部细胞分化为外胚层。基于此,胚胎发育成为具有内胚层、中胚层和外胚层的三胚层胚胎。经过复杂的信号通路调控,三胚层胚胎进一步形成各种器官原基,并最终形成我们身体中包括神经系统、消化系统、呼吸系统、心血管循环系统、泌尿生殖系统等所有系统的各种器官。原肠运动和三胚层分化异常与多种出生缺陷(如先天性心脏病和神经管畸形等)和发育源性疾病相关。了解人类早期胚胎发育过程及其机制对于这些疾病的诊断和治疗至关重要。为了精准地描述不同发育时期人类胚胎特征并进行物种间胚胎发育比较,自上世纪早期来自美国卡耐基研究所的Franklin Mall等人将人类胚胎发育的前60天(E0-E60)划分为23个发育时期,即Carnegie stage(CS1-CS23)[1]。目前,通过体外胚胎培养等方法,人类CS1-CS6(E0-E14)胚胎发育事件已被多个团队解析[2-5];借助一枚宝贵的在体胚胎,人类CS7胚胎的关键发育事件(原肠运动等)也开始被阐明[6],然而,由于临床诊疗规范限制,人CS8-11的正常胚胎极难获得,所以在此阶段发生的中晚期原肠运动和早期器官发育事件相关研究仍为空白。非人灵长类(如食蟹猴)在进化、生理特征及胚胎发育方面与人类高度类似,可作为研究人类早期胚胎发育的替代模型。由于人类早期胚胎难于获得,一些人类早期胚胎上难以回答的问题可借助非人灵长类胚胎实现。
2022年12月14日,中国科学院动物研究所、北京干细胞与再生医学研究院王红梅和郭帆团队、美国德克萨斯大学西南医学中心吴军团队以及安徽医科大学蒋祥祥团队合作(中国科学院动物研究所博士后翟晶磊、博士生郭敬、助理研究员万海峰、博士生齐鲁青和德克萨斯大学西南医学中心的博士后刘立中为本文共同第一作者)在Nature上发表了文章Primate gastrulation and early organogenesis at single-cell resolution[7]。研究者以食蟹猴为模型,利用单细胞转录组测序和干细胞分化模型等,绘制了食蟹猴CS8-CS11时期(E20-E29)胚胎的单细胞转录组图谱,揭示了原肠运动和三胚层分化(神经管、体节、肠管等的发育)过程中重要细胞类群的特征及其谱系发生和调控机制,并比较了啮齿类和灵长类早期胚胎发育事件的进化差异。
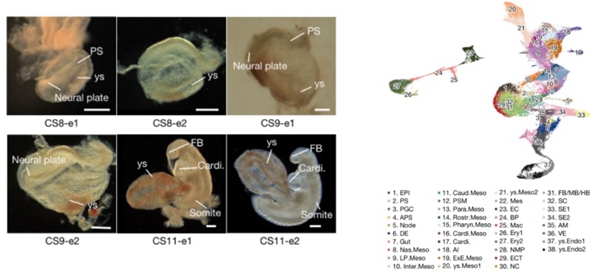
研究者收集了CS8-CS11阶段的食蟹猴胚胎,利用10X单细胞转录组测序技术捕获了56636个单细胞并进行生物信息学分析,明确定义了食蟹猴该时期的38个主要细胞类群,绘制了目前国际上第一张灵长类CS8-CS11胚胎的高通量单细胞转录组图谱(图1)。
啮齿类动物(小鼠)原肠运动阶段的胚胎三胚层细胞分化过程已有相对全面清晰的描述,但在灵长类动物上的研究仍非常有限。为了研究灵长类原肠运动阶段胚胎三胚层细胞分化的精细过程,研究者通过RNA轨迹分析描绘了原条细胞的三向分化潜能,分别为初始中胚层(nascent mesoderm)、定型内胚层和原结(node)。其中,初始中胚层可进一步分化为神经中胚层祖细胞(neuromesoderm progenitor, NMP)、前体节中胚层(presomite mesoderm, PSM)、轴旁中胚层(paraxial mesoderm)、中间中胚层(intermediate mesoderm)、侧板中胚层(lateral plate mesoderm)、生心中胚层(cardiac mesoderm)和胚外中胚层(extraembryonic mesoderm)等细胞类型;定型内胚层与原肠运动之前形成的脏壁内胚层(visceral endoderm)共同贡献于肠管(gut tube)的形成;原结进一步参与轴正中中胚层(axial mesoderm)的形成。此外,研究者基于生物信息学分析推测,由外胚层分化而来的神经管前后不对称和背腹不对称的发育模式是由WNT、SHH和TGB-β等信号在胚胎前后轴和背腹轴的不对称表达所介导的。
哺乳动物早期胚胎发育过程在进化上高度保守,但不同物种哺乳动物的早期胚胎发育过程仍存在特异的分子特征。研究者全面比较了相同发育阶段的小鼠和食蟹猴胚胎的转录组差异(图3),揭示了两物种胚胎中对应细胞类型的分化调控异同。研究发现,T、EOMES和TBX6基因在小鼠和食蟹猴的原条、初始中胚层、神经中胚层祖细胞和外胚层细胞中的表达模式不同。此外,与小鼠相比,Hippo信号通路的多个下游基因在食蟹猴的NMP/PSM中被显著上调。为深入研究Hippo信号通路在灵长类动物与啮齿类动物NMP/PSM形成过程中的不同作用,研究者构建了人、猴和小鼠胚胎干细胞诱导产生的NMP/PSM体外模型,通过添加抑制剂等实验,发现Hippo信号通路在灵长类NMP/PSM细胞仍保持高度活化状态,而在小鼠NMP/PSM细胞中被抑制(图3)。由此推测Hippo信号通路在人和猴NMP/PSM细胞中的高度活化状态可能与灵长类胚胎体轴更长、胚胎体积更大及发育周期更长等体征密切相关。
基于干细胞的人类胚胎模型(类胚胎)对于研究人胚胎早期发育研究至关重要。近年来,类原肠胚[8,9]、类神经胚[10-13]、心脏类器官[14]以及类体节[15]模型相继构建成功。然而,由于缺乏灵长类动物体内相应时期胚胎的发育数据,这些胚胎模型对在体真实胚胎的模拟程度无法被直接证实。本研究填补了这一空白,为未来相应时期胚胎模型的构建提供了在体的比对数据。并且,研究者利用这一在体数据,初步研究了上述胚胎模型与在体胚胎的相似度,发现上述胚胎模型在细胞类型方面与在体胚胎存在一定相似性,但在关键信号通路激活程度、转录因子表达等多方面与在体胚胎存在差异。
综上所述,本研究揭示了灵长类动物原肠运动至早期器官发育阶段胚胎的细胞组分与分子特征、细胞谱系发生过程及分子调控机制。该研究不仅填补了灵长类胚胎原肠运动至早期器官发育阶段的领域知识空白,而且为人类胚胎模型的研究提供了必要的在体数据参考,为深入了解人类早期胚胎发育过程的调控机理以及发育异常相关疾病的病理奠定坚实基础。
原文链接:https://www.nature.com/articles/s41586-022-05526-y
参考文献:
1. O’Rahilly, R. & Müller, F. Developmental stages in human embryos : including a revision of Streeter’s. In: "Horizons" and a Survey of the Carnegie Collection. Section1, Page 2-3. (Carnegie Institution of Washington, 1987)
2. Deglincerti, A., Croft, G. F., Pietila, L. N., Zernicka-Goetz, M., Siggia, E. D., & Brivanlou, A. H. Self-organization of the in vitro attached human embryo. Nature 533, 251-254 (2016)
3. Shahbazi, M. N., Jedrusik, A., Vuoristo, S., Recher, G., Hupalowska, A., Bolton, V., Fogarty, N. N. M., Campbell, A., Devito, L., Ilic, D., Khalaf, Y., Niakan, K. K., Fishel, S., & Zernicka-Goetz, M. Self-organization of the human embryo in the absence of maternal tissues. Nat Cell Biol. 18, 700-708 (2016)
4. Xiang, L., Yin, Y., Zheng, Y., Ma, Y., Li, Y., Zhao, Z., Guo, J., Ai, Z., Niu, Y., Duan, K., He, J., Ren, S., Wu, D., Bai, Y., Shang, Z., Dai, X., Ji, W., & Li, T. A developmental landscape of 3D-cultured human pre-gastrulation embryos. Nature 577, 537-542 (2020)
5. Zhou, F., Wang, R., Yuan, P., Ren, Y., Mao, Y., Li, R., Lian, Y., Li, J., Wen, L., Yan, L., Qiao, J., & Tang, F. Reconstituting the transcriptome and DNA methylome landscapes of human implantation. Nature, 572, 660-664 (2019)
6. Tyser, R. C. V., Mahammadov, E., Nakanoh, S., Vallier, L., Scialdone, A., & Srinivas, S. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature 600, 285-289 (2021)
7. Primate gastrulation and early organogenesis at single-cell resolution (Prepare for publication)
8. Minn, K. T. et al. High-resolution transcriptional and morphogenetic profiling of cells from micropatterned human ESC gastruloid cul tures. eLife 9, e59445 (2020).
9. Minn, K. T., Dietmann, S., Waye, S. E., Morris, S. A. & Solnica-Krezel, L. Gene expression dynamics underlying cell fate emergence in 2D micropatterned human embryonic stem cell gastruloids. Stem Cell Rep. 16, 1210–1227 (2021).
10. Rifes, P. et al. Modeling neural tube development by differentiation of human embryonic stem cells in a microfluidic WNT gradient. Nat. Biotechnol. 38, 1265–1273 (2020).
11. Haremaki, T. et al. Self-organizing neuruloids model developmental aspects of Huntington’s disease in the ectodermal compartment. Nat. Biotechnol. 37, 1198–1208 (2019).
12. Karzbrun, E. et al. Human neural tube morphogenesis in vitro by geometric constraints. Nature 599, 268–272 (2021).
13. De Santis, R., Etoc, F., Rosado-Olivieri, E. A. & Brivanlou, A. H. Self-organization of human dorsal-ventral forebrain structures by li ght induced SHH. Nat. Commun. 12, 6768 (2021).
14. Drakhlis, L. et al. Human heart-forming organoids recapitulate early heart and foregut development. Nat. Biotechnol. 39, 737–746 (2021).
15. Sanaki-Matsumiya, M. et al. Periodic formation of epithelial somites from human pluripotent stem cells. Nat. Commun. 13, 2325 (2022).
图1. CS8-CS11时期食蟹猴胚胎的明场图(左)与38种主要细胞类群(右)
图2. E22胚胎原条及其衍生物细胞类型分布示意图与免疫荧光图
图3. Hippo信号通路在灵长类与啮齿类NMP/PSM细胞的活化程度差异。
食蟹猴和小鼠Hippo信号通路差异基因表达模式(左);抑制Hippo信号通路对人、猴和小鼠PSM中YAP1分子表达的影响(中)及对人、猴、小鼠PSM分化的影响(右)。

焦建伟研究组揭示人类特异基因促进大脑皮层折叠新机制
2022年11月22日,中国科学院动物研究所、北京干细胞与再生医学研究院焦建伟研究组在Cell Discovery 杂志上发表了题为Human SERPINA3 induces neocortical folding and improves cognitive ability in mice的研究论文。这项研究发现人源基因SERPINA3促进了小鼠皮层的扩张和折叠的产生,增加了上层神经元的数量,并且明显改善了小鼠的认知能力。
2022-11-22
在人类进化过程中,新皮层的扩张与智力的提高和认知功能的改善密切相关。这种扩张的一个关键方面是大脑皮层沟回的形成,它使扩张的皮质表面积能够适应有限的颅骨空间。这些进化特征主要依赖于多种神经干细胞和祖细胞亚型及其神经源性分裂产生的更多数量的皮层神经元。近年来,许多研究都揭示了外放射状胶质细胞(oRG)与大脑皮层沟回形成有重要的联系,一是因为oRG作为人脑中大量存在的神经前体细胞,增加了神经祖细胞的种类和数量,二是oRG给神经元提供了更多的径向迁移的路径,从而促进皮层的扩张及沟回的形成。然而,大脑皮层折叠的分子和细胞机制仍然知之甚少。
2022年11月22日,中国科学院动物研究所、北京干细胞与再生医学研究院焦建伟研究组在Cell Discovery 杂志上发表了题为Human SERPINA3 induces neocortical folding and improves cognitive ability in mice的研究论文。这项研究发现人源基因SERPINA3促进了小鼠皮层的扩张和折叠的产生,增加了上层神经元的数量,并且明显改善了小鼠的认知能力。
研究首先构建了条件性敲入小鼠(cKI),在神经系统中过表达SERPINA3,结果发现SERPINA3能促进神经发育过程中小鼠大脑的神经干细胞的增殖以及oRG的产生。cKI小鼠出生后表现出大脑皮层表面积变大、皮层增厚的现象,以及沟回结构的形成。对新生小鼠的大脑皮层进行单细胞测序分析,进一步证明SERPINA3过表达增加了上层神经元的输出。成年后的cKI小鼠和野生型相比,在行为学实验中表现出更强的学习和记忆能力。
研究通过转录组测序还发现SERPINA3通过结合下游靶基因Glo1的promoter来调节其表达。Glo1作为调节丙酮醛代谢的关键因子,其表达上调后加速了丙酮醛的代谢,进而促进神经祖细胞的增殖和大脑皮层的扩张和折叠。
综上所述,该研究不仅揭示了SERPINA3对神经干细胞增殖能力及丰度的重要作用,也阐明了大脑皮层扩张以及折叠的一种新的分子机制。
中国科学院动物研究所焦建伟研究员为论文通讯作者,博士研究生赵津悦、冯超为论文共同第一作者。该研究得到了科技部、国家自然科学基金委、科学院先导等项目的资助。
原文链接:https://www.nature.com/articles/s41421-022-00469-0
图. SERPINA3在大脑皮层扩张和折叠中的作用模式图
干细胞院合作揭示延缓人类骨骼肌衰老的新靶标
2022年11月22日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组,首都医科大学宣武医院王思课题组以及中国科学院北京基因组研究所张维绮课题组合作,在Protein & Cell杂志在线发表题为“Single-nucleus profiling unveils a geroprotective role of the FOXO3 in primate skeletal muscle aging”的研究论文。该研究通过系统解析灵长类骨骼肌的衰老表型并绘制单细胞核转录组图谱,揭示了FOXO3作为维持骨骼肌稳态的枢纽转录因子,在拮抗人类骨骼肌衰老中发挥关键作用,为进一步开发针对骨骼肌衰老的诊断和干预策略提供了理论基础。
2022-11-22
骨骼肌是执行机体运动功能的主要组织器官之一。与衰老相关的骨骼肌质量和功能减退被称为肌肉减少症(Sarcopenia,肌少症),这种疾病将导致老年人运动能力、平衡能力等身体机能的显著下降,进而增加虚弱、跌倒、残疾甚至死亡的风险。此外,骨骼肌分泌的肌源因子会对全身产生系统性影响,对于维持机体的稳态和健康具有重要作用。因此,深入了解骨骼肌稳态维持及衰老驱动的机制具有重要的科学和临床意义。然而,由于骨骼肌组织结构的复杂性和肌纤维组成的异质性,传统的研究手段难以揭示骨骼肌中多核肌纤维细胞的特征性变化,目前人们对骨骼肌衰老的机制的认识还十分有限,也阻碍了相关干预手段的开发。
2022年11月22日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、曲静研究组,首都医科大学宣武医院王思课题组以及中国科学院北京基因组研究所张维绮课题组合作,在Protein & Cell杂志在线发表题为“Single-nucleus profiling unveils a geroprotective role of the FOXO3 in primate skeletal muscle aging”的研究论文。该研究通过系统解析灵长类骨骼肌的衰老表型并绘制单细胞核转录组图谱,揭示了FOXO3作为维持骨骼肌稳态的枢纽转录因子,在拮抗人类骨骼肌衰老中发挥关键作用,为进一步开发针对骨骼肌衰老的诊断和干预策略提供了理论基础。
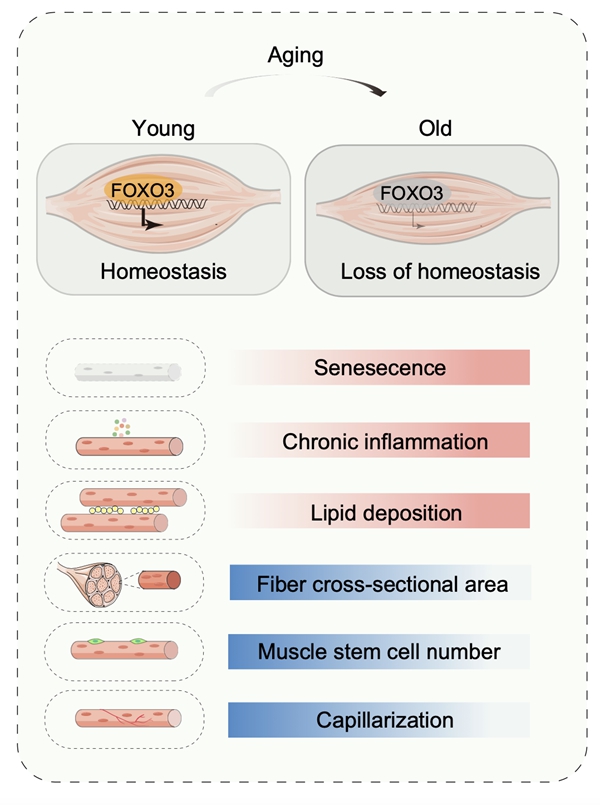
研究人员首先通过对年轻和年老的食蟹猴骨骼肌进行组织学分析,发现了骨骼肌衰老过程出现肌纤维萎缩、快肌减少、慢肌增多、肌肉干细胞减少、肌间脂质积累、神经肌肉接头受损、凋亡增加、核纤层加速丢失、核内异染色质损耗等一系列衰老特征。为了在单细胞分辨率解析灵长类骨骼肌衰老的细胞分子变化规律,研究人员进一步构建了食蟹猴骨骼肌衰老的单细胞核转录组图谱,系统揭示了骨骼肌组织中存在的14种细胞核类型,包括I型慢肌纤维、IIA型快肌纤维、IIX型快肌纤维、神经肌肉接头突触后肌纤维等4种来自多核肌纤维的细胞核,以及肌肉干细胞、内皮细胞、平滑肌细胞、肌腱成纤维细胞、成纤维细胞/成纤维脂肪生成祖细胞、巨噬细胞等肌间质细胞。
尽管骨骼肌衰老过程中不同类型细胞的身份特征保持相对恒定,但特殊细胞群体的比例发生了变化,例如肌肉干细胞和内皮细胞的减少等。通过对转录噪音和衰老相关差异基因进行分析,发现骨骼肌纤维对衰老具有更高的易感性,主要反映为肌纤维具有较高的转录噪音以及衰老相关差异表达的基因。进一步分析发现,FOXO3在衰老的多种细胞(包括肌纤维细胞)中均出现下调变化。与骨骼肌衰老相关退行疾病数据库的联合分析表明,FOXO3与多种骨骼肌退行性疾病密切相关。此外,研究人员构建了骨骼肌衰老的核心转录因子网络,也发现FOXO3在下调的转录调控网络中处于核心位置。进一步的实验证明了FOXO3在食蟹猴骨骼肌组织和人类骨骼肌样本中均呈现出增龄伴随的蛋白质水平下调,提示衰老过程中FOXO3蛋白的活力降低是灵长类骨骼肌衰老的共性特征。
为了深入探究FOXO3对人类骨骼肌衰老的潜在调控作用,研究人员建立了人多能干细胞定向诱导分化为肌管细胞的研究体系。研究发现,与衰老的人类骨骼肌组织类似,衰老的人肌管细胞中FOXO3的表达水平也发生下调。此外,敲低或敲除FOXO3的人肌管细胞也表现为一系列衰老相关表型,包括肌管直径减小和衰老标志物的增加。进而,研究人员通过基因编辑产生了内源FOXO3激活的遗传增强型人类肌管细胞,并证明了主动增加FOXO3的活力可显著延缓人类肌管细胞的衰老。
该研究首次绘制了灵长类骨骼肌衰老的单细胞核转录组图谱,系统解析了不同类型骨骼肌细胞随增龄发生的特异性分子变化规律;同时结合人类肌管衰老的研究体系,揭示了长寿蛋白FOXO3在拮抗人类骨骼肌衰老中的重要作用。这项研究为理解人类骨骼肌衰老的分子机制、诊断和治疗骨骼肌衰老及相关疾病提供了理论依据。
中国科学院动物研究所博士研究生经瑛、中国科学院北京基因组研究所硕士研究生左越晟、北京大学第三医院于洋研究员、北京医院/国家卫健委国家老年医学中心孙亮研究员、北京大学第一医院于峥嵘副主任医师为该论文的共同第一作者。中国科学院动物研究所刘光慧研究员、曲静研究员,首都医科大学宣武医院国家老年疾病临床医学研究中心王思研究员以及中国科学院北京基因组研究所张维绮研究员为共同通讯作者。该研究获得了科技部、国家自然科学基金委、中国科学院、北京市等项目的资助。
相关数据已上传至衰老多组学数据库Aging Atlas:https://ngdc.cncb.ac.cn/aging/index
原文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwac061/6839274
图1. 灵长类骨骼肌衰老的表型和机制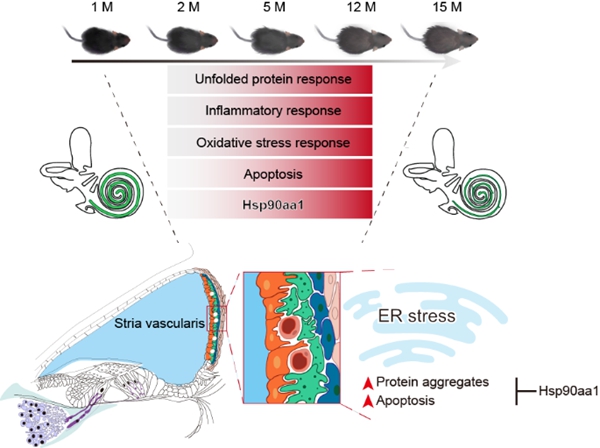
干细胞院合作揭示耳蜗衰老的细胞分子基础
2022年11月12日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、东南大学柴人杰课题组、首都医科大学宣武医院王思课题组以及中国科学院动物研究所、北京干细胞与再生医学研究院曲静研究组合作,在Protein & Cell杂志在线发表题为“Single-cell Transcriptomic Atlas of Mouse Cochlear Aging”的研究论文。该研究首次系统地绘制了小鼠耳蜗衰老的高分辨跨时序单细胞转录组图谱,揭示了增龄伴随的耳蜗功能减退的关键时间节点以及细胞分子调控机制,为发掘耳蜗衰老及相关退变的早期预警标志和潜在干预靶标提供了理论依据。
2022-11-12
作为五大感觉器官之一,耳蜗能够感知外界的声波震动,将声音信号转换为电信号传递到大脑的颞叶形成听觉。随着年龄的增长,耳蜗的生理功能逐渐退化,从而导致老年性耳聋的发生,严重影响老年人的生活质量。解析耳蜗衰老的机制是理解并干预老年性耳聋的重要基础。然而,耳蜗结构精巧且复杂,由耳蜗柯蒂氏器、基底膜、蜗轴、血管纹、螺旋韧带等不同解剖区域组成,包含数十种细胞类型,传统方法难以精确揭示耳蜗衰老过程中不同细胞类型的衰老规律及分子调控网络。
2022年11月12日,中国科学院动物研究所、北京干细胞与再生医学研究院刘光慧研究组、东南大学柴人杰课题组、首都医科大学宣武医院王思课题组以及中国科学院动物研究所、北京干细胞与再生医学研究院曲静研究组合作,在Protein & Cell杂志在线发表题为“Single-cell Transcriptomic Atlas of Mouse Cochlear Aging”的研究论文。该研究首次系统地绘制了小鼠耳蜗衰老的高分辨跨时序单细胞转录组图谱,揭示了增龄伴随的耳蜗功能减退的关键时间节点以及细胞分子调控机制,为发掘耳蜗衰老及相关退变的早期预警标志和潜在干预靶标提供了理论依据。
在该项研究中,研究人员分别获取了1、2、5、12、15月龄C57BL/6J小鼠的耳蜗组织,通过听力功能检测发现:随着月龄增加,C57BL/6J小鼠表现出高频听力丢失的特征,这与人类老年性耳聋的特征较为相似。进一步的组织学分析发现,耳蜗衰老的特征表现为:内毛细胞、外毛细胞、螺旋神经元和螺旋韧带区域的纤维细胞等重要细胞类型均发生了不同程度的丢失,以及衰老相关的血管纹萎缩等。为明确小鼠耳蜗衰老过程中的细胞和分子变化规律,研究人员利用高通量单细胞转录组测序技术,系统地揭示了耳蜗柯蒂氏器、基底膜、蜗轴、血管纹、螺旋韧带等区域,包括毛细胞(Hair cell, HC)、螺旋神经元(Spiral ganglion neuron, SGN)、血管纹中层细胞(Intermediate cell, IC)等在内的27种耳蜗细胞类型衰老伴随的基因表达特征。
研究发现,耳蜗细胞的转录噪音随着增龄而升高,表明衰老导致耳蜗细胞RNA表达的不稳定性增加。其中,血管纹中层细胞转录噪音的增加尤为显著。为了确定耳蜗衰老的时间规律,研究人员通过不同时间点之间的配对比较分析,鉴定了特定时间点之间的差异基因(Pairwise differentially expressed genes,PDEGs),并发现5月龄时小鼠耳蜗已经展现出细胞衰老的转录谱特征。通过分析PDEGs的数量,发现血管纹中层细胞在衰老过程中表现出较多的基因表达差异。不同于时间点之间的两两比较,多个时间节点能够识别动态差异表达基因(Dynamic differentially expressed genes,DDEGs),以高分辨率的形式研究基因表达随时间的连续变化理论上更能揭示耳蜗衰老的跨时序变化规律。因此,研究人员进一步通过构建相应算法并鉴定出包括持续上调和持续下调等6种表达模式的DDEGs基因集,其中血管纹中层细胞拥有较多的持续上调和持续下调的差异表达基因。持续上调的基因主要与未折叠蛋白反应(UPR)、细胞凋亡、以及免疫炎性反应相关,持续下调的基因主要与离子转运、细胞基质黏附等相关,提示耳蜗衰老过程中伴随着细胞损伤的累积和功能下降。
研究人员进一步聚焦于血管纹中层细胞,通过对UPR通路的详细分析,发现UPR的三个主要分支通路(包括ATF6、IRE1和PERK信号通路)的相关基因的表达均随着衰老上调。一方面,UPR下游的应激代偿通路,包括内质网分子伴侣、内质网相关蛋白降解、NRF2等通路相关基因的表达随衰老而升高。另一方面,凋亡相关基因的表达也呈现出増龄伴随的上调。这些结果提示UPR代偿通路不足以抵消增龄伴随的持续的内质网应激,无法阻止耳蜗衰老相关损伤,进而引起中层细胞的凋亡。此外,研究发现血管纹中层细胞中UPR相关基因Hsp90aa1的上调最为明显,提示其可能作为耳蜗衰老相关损伤的潜在调控因子在中层细胞衰老中发挥作用。实验表明,在小鼠血管纹细胞中敲低Hsp90aa1可加剧细胞的UPR和凋亡程度,而激活Hsp90aa1可减轻应激压力下细胞内蛋白聚集并拮抗细胞凋亡。以上研究成果提示靶向Hsp90aa1-UPR通路可能为耳蜗衰老的干预提供新思路、新策略。
该研究首次报道了小鼠耳蜗衰老的跨多时间点的高分辨单细胞转录组景观图谱,系统地解析了耳蜗组织中多种细胞类型随衰老变化的规律,揭示了耳蜗衰老的新的分子特征。研究不仅加深了人们对耳蜗结构和功能增龄性退变的认识,阐明了耳蜗衰老过程的关键易感细胞类型及易感分子,且为评估耳蜗衰老程度及预警老年性耳聋提供了潜在的诊断生物标志物,为发展靶向耳蜗衰老的干预新策略奠定了理论基础。
中国科学院动物研究所刘光慧研究员、东南大学柴人杰教授、首都医科大学宣武医院王思研究员、中国科学院动物研究所曲静研究员为该论文共同通讯作者。中国科学院动物研究所博士研究生孙国强、郑彦东,东南大学付晓龙副教授,中国科学院北京基因组研究所张维绮、任捷研究员为该论文共同第一作者。研究获得了国家科技部、国家自然科学基金委、中国科学院等项目的资助。
相关数据已上传至衰老多组学数据库Aging Atlas (https://ngdc.cncb.ac.cn/aging/landscape?project=Mouse_Cochlea)。
原文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwac058/6823876
图:小鼠耳蜗衰老的细胞分子机制
王金勇研究组建立诱导人多能干细胞分化再生NK细胞新技术
2022年11月8日,中国科学院动物研究所干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王金勇研究团队在Cell Discovery在线发表了题为Lateral plate mesoderm cell-based organoid system for NK cell regeneration from human pluripotent stem cells的研究论文。该研究首次采用人类多能干细胞来源的高纯度侧板中胚层细胞和滋养细胞来组装类器官聚集体,利用气液交界面进行培养诱导,实现NK细胞(iNK)体外再生。与传统方法比较,这种诱导策略具有耗时短、产量高、成熟度高、无需二次扩增、成本低等特点。针对多种肿瘤类型的杀伤试验证实iNK细胞具有广谱、高效的抗肿瘤活性。本研究提供了一种可规模化制备人类多能干细胞来源再生型iNK细胞的新方法。
2022-11-08
2022年11月8日,中国科学院动物研究所干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王金勇研究团队在Cell Discovery在线发表了题为Lateral plate mesoderm cell-based organoid system for NK cell regeneration from human pluripotent stem cells的研究论文。该研究首次采用人类多能干细胞来源的高纯度侧板中胚层细胞和滋养细胞来组装类器官聚集体,利用气液交界面进行培养诱导,实现NK细胞(iNK)体外再生。与传统方法比较,这种诱导策略具有耗时短、产量高、成熟度高、无需二次扩增、成本低等特点。针对多种肿瘤类型的杀伤试验证实iNK细胞具有广谱、高效的抗肿瘤活性。本研究提供了一种可规模化制备人类多能干细胞来源再生型iNK细胞的新方法。
NK细胞可以直接广谱杀伤各种肿瘤细胞,毒副作用小,过继治疗不需要配型,是理想的现货式免疫细胞治疗药物。当前临床治疗用的NK细胞主要来源于脐带血和外周血等人体组织,这些天然来源的NK细胞异质性大,制备成本高昂、产量低、制备周期受人体组织可及性限制。人类多能干细胞诱导分化来源的NK细胞有望解决上述问题。传统采用的多能干细胞分化再生NK细胞的方法,需要经历拟胚体中间体阶段,需要借助扩增饲养细胞进一步大规模扩增,获得的iNK细胞活性差。王金勇研究组开发出了一种不依赖拟胚体,基于侧板中胚层为起始种子细胞的类器官聚集体组装方式,实现iNK细胞高效再生。在27天的诱导周期内,投入百万数量级别的多能干细胞,可输出超过十亿数量级别的iNK细胞。本研究诱导再生的iNK细胞高表达经典的细胞毒性颗粒(穿孔素和颗粒酶B),凋亡诱导相关配体(FasL和TRAIL)以及一系列NK细胞激活性和抑制性受体。在功能上,iNK细胞可通过直接毒杀、诱导靶细胞凋亡和抗体依赖的细胞介导的细胞毒性作用的方式杀伤人类肿瘤细胞。本研究为大规模生产现货式、通用型和再生型NK细胞药物提供了关键技术支撑,促进iNK细胞临床转化应用,惠及患者。基于该技术制备的iNK细胞,已经用于临床试验。
中国科学院动物研究所干细胞与生殖生物学国家重点实验室博士后黄德浩、中国科学院广州生物医药与健康研究院博士生李剑焕、北京干细胞与再生医学研究院青年学者胡房晓、夏成祥博士,为该论文的共同第一作者,王金勇研究员为该论文的通讯作者。该研究得到国家重点研发计划、中国科学院战略性先导科技专项和国家自然科学基金杰出青年基金等项目的资助。该研究还得到中国科学院动物研究所实验动物中心、仪器中心、国家干细胞资源库等先进平台部门的大力支持。
原文链接:https://doi.org/10.1038/s41421-022-00467-2
图:人类多能干细胞诱导再生NK细胞技术示意图
合作建立细胞谱系景观数据库
2022年10月28日,中国科学院动物研究所、北京干细胞与再生医学院刘光慧研究组、中国科学院计算机网络信息中心周园春研究组、中国科学院动物研究所、北京干细胞与再生医学院曲静研究组和北京基因组研究所(国家生物信息中心)张维绮研究组合作在Nucleic Acids Research杂志发表论文“Lineage Landscape: a comprehensive database that records lineage commitment across specie”,建立了细胞多谱系全景数据库“Lineage Landscape(LL)”,从转录组、单细胞转录组、表观基因组等不同层面的数据集,捕捉了人类和经典模式生物等10余个物种从胚胎、胎儿、成人到老年阶段细胞谱系的变化,实现了不同条件下基因表达改变的汇聚融合。
2022-10-28
细胞谱系形成和转化在哺乳动物整个生命周期中经历了复杂的转录和表观遗传改变。深入研究谱系分化、维持和退变有助于全面了解器官发育、稳态、衰老和疾病等重要生物学过程。随着高精度多组学技术的迅猛发展,针对人类和小鼠等模式生物的谱系相关研究已产生海量数据;建立相关的数据资源平台用以存储、管理和整合多组学数据已成为迫切需求。
2022年10月28日,中国科学院动物研究所、北京干细胞与再生医学院刘光慧研究组、中国科学院计算机网络信息中心周园春研究组、中国科学院动物研究所、北京干细胞与再生医学院曲静研究组和北京基因组研究所(国家生物信息中心)张维绮研究组合作在Nucleic Acids Research杂志发表论文“Lineage Landscape: a comprehensive database that records lineage commitment across specie”,建立了细胞多谱系全景数据库“Lineage Landscape(LL)”,从转录组、单细胞转录组、表观基因组等不同层面的数据集,捕捉了人类和经典模式生物等10余个物种从胚胎、胎儿、成人到老年阶段细胞谱系的变化,实现了不同条件下基因表达改变的汇聚融合。
Lineage Landscape数据库实现了对细胞谱系不同层次、不同时期的多维组学数据的收录和整合。用户可以方便地访问并查询兴趣基因在不同物种、不同发育阶段的变化。总体而言,Lineage Landscape收集了超过660万个细胞的数据,包括1500万个差异表达基因条目信息。数据库将不断更新和整合不同组学层次的高质量数据集,从而为相关研究领域提供宝贵的资源。此外,团队于2020年建立了Aging Atlas(AA)数据库,于2021年建立了Regeneration Roadmap(RR)数据库。这些数据库迄今已服务来自全球75个国家的16万名访问者。Lineage Landscape (LL)、Aging Atlas (AA)和Regeneration Roadmap (RR) 三个姊妹库将形成资源互补,共同推动发育、衰老和再生生物学的学科发展。
该数据库由中国科学院动物研究所、北京干细胞与再生医学研究院、中国科学院计算机网络信息中心、中国科学院干细胞与再生医学科学数据中心、中国科学院数据总中心、中国科学院北京基因组所、首都医科大学宣武医院国家老年疾病临床研究中心等机构合作完成。中国科学院动物研究所刘光慧研究员、中国科学院计算机网络信息中心周园春研究员、中国科学院动物研究所曲静研究员和中国科学院北京基因组研究所张维绮研究员为共同通讯作者。首都医科大学博士研究生燕浩腾、中国科学院计算机网络信息中心助理工程师王容昊、中国科学院动物研究所、北京干细胞与再生医学研究院“致一”研究员马帅、中国科学院计算机网络信息中心工程师黄道然、首都医科大学宣武医院国家老年疾病临床研究中心研究员王思、中国科学院北京基因组研究所研究员任捷为共同第一作者。此外,数据库建设也得到了中国科学院计算机网络信息中心高级工程师陈昕和高级工程师路长发的支持。
文章链接:https://doi.org/10.1093/nar/gkac951
数据库(LL)链接:http://data.iscr.ac.cn/lineage/#/home
数据库(AA)链接:https://ngdc.cncb.ac.cn/aging/index
数据库(RR)链接:https://ngdc.cncb.ac.cn/regeneration/index
图1. Lineage Landscape数据库
王皓毅团队报道BATF缺失可提高CAR-T细胞抗肿瘤活性
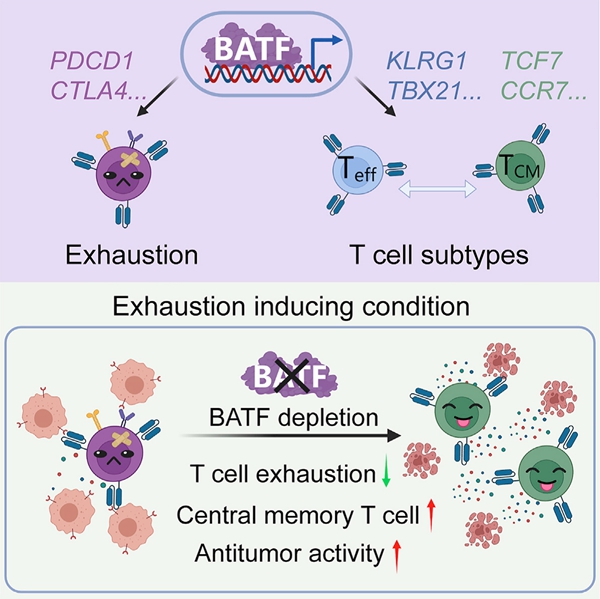
北京干细胞与再生医学研究院王皓毅团队在Cancer Cell上发表题为Depletion of BATF in CAR-T cells enhances antitumor activity by inducing resistance against exhaustion and formation of central memory cells的最新研究成果。首先,为了更好的研究T细胞耗竭过程与机制,该研究通过降低CAR-T细胞与肿瘤细胞的比例并延长共培养,在体外获得具有典型耗竭特征的人原代CAR-T细胞耗竭模型。为了发现新的T细胞耗竭调控因子,该研究基于这一模型进行了候选基因的筛选,发现敲除转录因子BATF可以显著提高CAR-T细胞的体内、外抗肿瘤活性。后续的机制研究中发现,BATF直接靶向结合耗竭相关的多个关键基因并上调其表达,同时BATF靶向并调控效应及记忆T细胞相关基因的表达。因此,敲除BATF在提高CAR-T细胞抵抗耗竭能力的同时使得CAR-T细胞产生更多的中央记忆细胞亚群,进而提高了CAR-T细胞治疗实体瘤的效果。
2022-10-13
T细胞在抗原的持续刺激下会逐渐丧失对肿瘤细胞的杀伤能力,同时伴随着多种抑制性受体的上调,增殖分化能力的下降,转录组和表观遗传组的重塑等,这种现象被称为T细胞耗竭。T细胞耗竭最初在慢性病毒感染环境中发现,后来在肿瘤病人中也发现了这一现象。T细胞耗竭是CAR-T等T细胞免疫疗法攻克实体肿瘤的主要障碍之一,进一步理解和调控这一过程是提高基于T细胞的免疫治疗临床效果的关键。
2022年10月13日,中国科学院动物研究所、干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王皓毅团队在Cancer Cell上发表题为Depletion of BATF in CAR-T cells enhances antitumor activity by inducing resistance against exhaustion and formation of central memory cells的最新研究成果。首先,为了更好的研究T细胞耗竭过程与机制,该研究通过降低CAR-T细胞与肿瘤细胞的比例并延长共培养,在体外获得具有典型耗竭特征的人原代CAR-T细胞耗竭模型。为了发现新的T细胞耗竭调控因子,该研究基于这一模型进行了候选基因的筛选,发现敲除转录因子BATF可以显著提高CAR-T细胞的体内、外抗肿瘤活性。后续的机制研究中发现,BATF直接靶向结合耗竭相关的多个关键基因并上调其表达,同时BATF靶向并调控效应及记忆T细胞相关基因的表达。因此,敲除BATF在提高CAR-T细胞抵抗耗竭能力的同时使得CAR-T细胞产生更多的中央记忆细胞亚群,进而提高了CAR-T细胞治疗实体瘤的效果。
近年来,已有多项研究表明多种转录因子参与调控T细胞耗竭过程,如TOX,NR4A,c-jun等。对于转录因子BATF,其在T细胞耗竭中的作用颇有争议,在以往的研究中报道了不同的结论。一方面,有研究称PD-1通过上调BATF的表达而导致T细胞耗竭,也有研究表明CAR-T细胞敲除BATF提高了效应因子IL-2及IFNγ的分泌;而另一方面,有研究发现BATF的缺失降低了T细胞分泌IFNγ及增殖的能力。同时,也有研究认为BATF可以阻断CAR-T细胞的耗竭,过表达BATF使CAR-T细胞具有更强的增值能力和肿瘤杀伤能力,并产生长期的肿瘤抑制效果。这些看似相反的结论,使团队更加有兴趣去解析清楚BATF到底是如何调控T细胞耗竭的。
为了进一步验证BATF的功能,该研究进行了更为深入细致的研究。通过在人的6种不同CAR-T细胞及小鼠的OT-1 T细胞中进行BATF的敲除和过表达,在不同耗竭诱导的条件下,该研究均发现BATF敲除可以提高CAR-T/OT-1 T细胞抗肿瘤活性,而BATF过表达则降低了CAR-T/OT-1 T细胞的杀伤能力。进一步分析发现BATF在不同的CAR-T细胞耗竭情况下发挥的作用是不同的,随着耗竭程度的加深(效靶比的降低或者肿瘤刺激轮次的增加),BATF对CAR-T细胞功能的影响越来越显著。同时该研究也发现BATF直接结合和上调一系列与细胞增殖有关的基因,因此,在非耗竭的实验条件下,BATF的过表达可以促进T细胞增殖,因此在整体上增强了其功能。但是在引发T细胞严重耗竭的实验条件下,BATF促进耗竭的功能就起了主导作用。因此,该研究的数据很好的说明了为什么前期的研究会得出关于BATF功能相反的结论。
作为一个转录调控因子,该研究表明BATF特异性的结合在T细胞耗竭、增殖、以及亚型分化相关的基因上并调控其表达,体现出多方面的功能。基因总是在与其作用环境相互作用中发挥功能的,因此当研究和阐释一个基因的功能的时候,选择不同的实验条件很可能会得出不同的结论。该研究认为,在大多数情况下浸润至肿瘤的CAR-T细胞会处于耗竭的状态,因此该研究建立的人原代CAR-T细胞体外耗竭模型是研究耗竭相关基因功能和机制的理想工具。
综上所述,研究发现转录因子BATF在CAR-T细胞耗竭过程中发挥着重要作用,敲除BATF可以提高CAR-T细胞的抗耗竭能力及形成中央记忆细胞的能力,从而产生持久有效的抗肿瘤效果。BATF缺失的CAR-T细胞在未来的临床应用中具有持久性和有效性的优势。
中国科学院动物研究所博士研究生张兴颖,张晨泽及硕士研究生乔苗苗为论文共同第一作者。中国科学院动物研究所、干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王皓毅研究员为本文的通讯作者。
图1 BATF在CAR-T细胞耗竭诱导条件下的功能
原文链接:https://doi.org/10.1016/j.ccell.2022.09.013
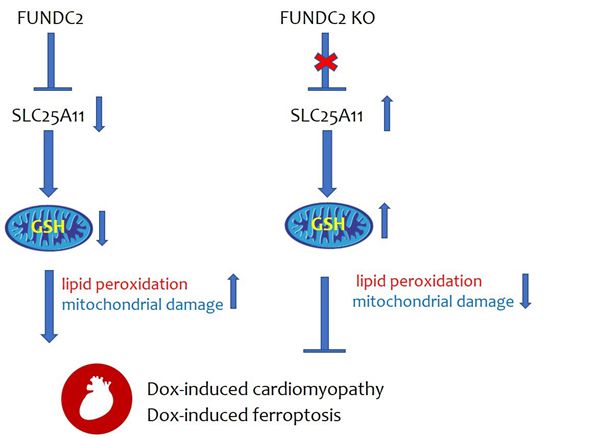
细胞器稳态与疾病研究组合作发现线粒体外膜蛋白FUNDC2介导阿霉素引起的铁死亡和心肌损伤的机制
2022年8月29日,干细胞研究院刘垒研究组与南开大学陈佺课题组联合在PNAS杂志上发表了题为 "Mitochondrial outer membrane protein FUNDC2 promotes ferroptosis and contributes to doxorubicin (DOX)-induced cardiomyopathy."的研究成果,详细阐明了线粒体外膜蛋白FUNDC2通过调控SLC25A11蛋白稳定性促进铁死亡,从而参与阿霉素诱导的心肌病的分子机制。
2022-08-31
阿霉素(Doxorubicin)是目前临床上使用的一种广谱抗肿瘤药物,对多种肿瘤均有治疗作用。然而,阿霉素能引起扩张型心肌病伴心肌细胞死亡增强,严重时可导致心力衰竭,心脏毒性很大程度上限制了它在临床上的使用。铁死亡是一种近年来新发现的细胞程序性死亡形式,其主要标志是铁依赖的脂质过氧化的增加。研究表明,阿霉素能引起心肌细胞的铁死亡,同时铁死亡的抑制剂能明显减轻阿霉素的心肌毒性。细胞的细胞膜中产生抗氧化剂谷胱甘肽(GSH),会通过线粒体内膜的特定孔道蛋白SLC25A11(solute carrier family 25 member 11)被转移到线粒体中,发挥抗氧化功能。但是在铁死亡应激条件下,线粒体内的GSH水平是如何被调控的分子机制仍不清楚。FUNDC2是一个线粒体外膜蛋白,前期的研究表明其可能通过调控AKT信号通路参与缺氧诱导的血小板死亡调控,但是FUNDC2蛋白的其它功能及其在铁死亡中的作用有待进一步研究。
2022年8月29日,干细胞研究院刘垒研究组与南开大学陈佺课题组联合在PNAS杂志上发表了题为 "Mitochondrial outer membrane protein FUNDC2 promotes ferroptosis and contributes to doxorubicin (DOX)-induced cardiomyopathy."的研究成果,详细阐明了线粒体外膜蛋白FUNDC2通过调控SLC25A11蛋白稳定性促进铁死亡,从而参与阿霉素诱导的心肌病的分子机制。
研究发现,尽管FUNDC2蛋白在心脏中表达量较高,但是 FUNDC2敲除的小鼠心脏功能正常。然而当利用阿霉素处理小鼠后,FUNDC2敲除的小鼠能够抵抗其引起的心脏功能下降和心肌纤维化,FUNDC2的敲除能抑制阿霉素引起心肌细胞线粒体形态的改变和铁死亡发生,提示FUNDC2在阿霉素引起的心肌损伤中发挥着重要作用。同时,细胞水平的研究也发现FUNDC2的敲除或敲减也能够抑制Erastin和阿霉素引起的铁死亡,而这种抑制作用与线粒体内的GSH含量密切相关。进一步的机制研究表明,FUNDC2与线粒体内膜的GSH转运蛋白SLC25A11有直接的互作,铁死亡刺激情况下,两者的互作增强,降低SLC25A11稳定性和二聚体的形成,引起线粒体内GSH含量下降,线粒体发生氧化损伤和形态功能异常,最终导致脂质过氧化和铁死亡;FUNDC2缺失后,SLC25A11蛋白稳定性增强,同时形成更多功能性的二聚体,使得线粒体内的GSH含量上升,从而能抵抗铁死亡的发生。
总之,该研究聚焦于线粒体外膜蛋白FUNDC2对阿霉素引起的铁死亡和心肌病调控,揭示了FUNDC2-SLC25A11轴通过调控线粒体GSH量参与铁死亡的分子机制;该研究有助于进一步理解线粒体稳态与铁死亡及相关疾病关系,对于相关疾病的预防和治疗提供了新的思路。
中国科学院动物研究所塔娜博士为本研究的第一作者,刘垒研究员和南开大学陈佺教授为并列通讯作者。该研究得到了国家自然科学基金委重大项目以及重大研究计划和科技部国家重点研发计划的支持。
图1 FUNDC2介导阿霉素引起的铁死亡和心肌病的模式图
原文链接: https://www.pnas.org/doi/10.1073/pnas.2117396119

建物致知:开发染色体编辑新技术创建全新核型小鼠
2022年8月26日,Science 杂志在线发表了中国科学院动物研究所、北京干细胞与再生医学研究院李伟研究员与周琪研究员团队合作完成的题为A sustainable mouse karyotype created by programmed chromosome fusion 的研究论文。该研究首次实现了哺乳动物完整染色体的可编程连接,并创建出具有全新核型(染色体组型)的小鼠。这项工作意味着生物工程技术的再次突破,为深入认识哺乳动物染色体大规模重构等结构变异对其生长发育、繁殖演化、乃至物种形成等的分子机制,开拓了“建物致知”的合成生物学研究策略并奠定了相应的技术平台。
2022-08-26
2022年8月26日,Science 杂志在线发表了中国科学院动物研究所、北京干细胞与再生医学研究院李伟研究员与周琪研究员团队合作完成的题为A sustainable mouse karyotype created by programmed chromosome fusion 的研究论文。该研究首次实现了哺乳动物完整染色体的可编程连接,并创建出具有全新核型(染色体组型)的小鼠。这项工作意味着生物工程技术的再次突破,为深入认识哺乳动物染色体大规模重构等结构变异对其生长发育、繁殖演化、乃至物种形成等的分子机制,开拓了“建物致知”的合成生物学研究策略并奠定了相应的技术平台。
染色体是遗传物质DNA的主要载体,其在细胞中的组成及形态特征被称为核型(染色体组型)。在漫长的生物演化过程中,染色体会发生重排(Chromosomal Rearrangement),啮齿类动物每百万年就会积累3.2-3.5种染色体重排,而灵长类动物在每百万年也会积累1.6种染色体重排。最典型的例子是灵长类动物进化过程中,两条端着丝粒染色体通过罗伯逊融合形成了人类的2号染色体,而这两条染色体在黑猩猩中却仍然是分离的,因此人类有46条染色体,但黑猩猩却有48条染色体。除了对于物种进化的重要意义,个体水平上发生的染色体重排往往会导致疾病的发生,如单亲二倍化,不孕不育和儿童白血病等等。因此,在实验室建立精准的染色体重排工程技术,对于研究染色体重排在物种进化、个体生殖发育与疾病中的作用具有重要价值。近些年,随着基因组编辑技术的进展,染色体精准重排率先在基因组组成简单且为单倍体的酵母上获得成功。但是哺乳动物基因组比酵母基因组复杂得多,目前对哺乳动物染色体的重排只限于亚染色体水平,在哺乳动物上进行完整染色体的重排仍然面临巨大挑战。
本研究利用小鼠单倍体干细胞和基因编辑工具,建立了哺乳动物染色体可编程连接技术,成功将最长的染色体1号和2号(哺乳动物染色体通常按照长度由大到小顺序编号)、以及中等长度的5号和4号染色体进行首尾连接,通过染色体DNA-FISH,核型分析,以及HiC等方式进一步确认了染色体的连接,同时发现染色体连接过程中可能会发生染色体的断裂和重新连接。这些结果表明两条独立存在的染色体可以通过基因编辑后非同源末端连接修复的方式连接为同一条染色体,从而首次实现了哺乳动物的完整染色体重排。
在此基础上,研究人员进一步研究了特定染色体重排连接产生的生物学影响。在细胞表型层面上,染色体连接后干细胞的多能性基因表达以及分化没有发生明显的变化,而最长染色体连接(2号和1号染色体连接)的单倍体干细胞二倍化速率显著加快,且已经成为二倍体的胚胎干细胞及神经干细胞中仍会发生自发多倍化。研究证实,该现象是由于染色体长度过长致使细胞分裂异常而导致。也证明了哺乳动物细胞的染色体长度存在一定限制,对小鼠细胞而言,染色体长度上限范围在308.3Mb – 377.6Mb之间。
为了解答特定染色体重排在动物表型层面上的影响,研究人员通过单倍体干细胞注射到卵母细胞的方式获得染色体连接的小鼠。研究发现不同的染色体连接对小鼠产生了不同的影响,其中最长的染色体连接(2号和1号染色体连接)使得胚胎发育不能正常进行,胚胎停滞于 E12.5之前;1号和2号染色体连接后,1号染色体断裂重新连接17号染色体,产生的小鼠则表现出了生长曲线和行为学的异常;4号和5号染色体连接的小鼠则没有表现出明显的异常。连接后的染色体还能够传递到后代小鼠,且进一步交配可以产生纯合小鼠,也就证明了两条染色体的连接不会导致绝对的生殖隔离。但携带连接染色体的小鼠生殖力明显下降,进一步探索发现,连接后的染色体虽然仍然能够与两条分离的同源染色体进行正常联会,但是联会后的同源染色体分离会出现异常。这些发现解析了染色体连接会对动物发育、行为和生殖等产生多方面的影响。
最后,研究人员还综合分析了染色体空间结构在胚胎干细胞、神经干细胞和脑内的变化趋势,发现随着分化的进行,染色体的空间结构变化随着分化而减弱。
该研究首次建立了哺乳动物完整染色体可编程连接的新技术,实现了对于超大规模基因组的编辑,为哺乳动物合成生物学增添了新的研究工具。利用合成生物学“建物致知”的研究思路,借助核型重构的独特细胞和小鼠模型,研究发现了染色体长度的限制,为哺乳动物合成生物学进行染色体设计合成提供了重要参考;揭示了染色体重排对生殖的影响,证明了染色体重排与生殖隔离的相关性,为进化生物学研究提供了新的思路。这项研究也为建立染色体重排疾病的动物模型,研究染色体重排导致的不孕不育和肿瘤等疾病的发病机制提供了新的技术手段。
染色体连接示意图及FISH检测结果
染色体连接小鼠“小竹”,拥有独特的染色体组型
原文链接:https://www.science.org/doi/10.1126/science.abm1964
