
科学研究
科研进展
干细胞院合作建立体外生命孕育平台:仿生子宫培养囊胚至心跳出现
干细胞与再生医学研究院顾奇研究员、王红梅研究员与中科院理化所王树涛研究员团队联合攻关,耗时近5年,开发仿生子宫,控制胚外组织迁移组装,模拟胚胎着床,首次成功将E3.5胚胎在体外发育至早期器官发生阶段(E8.5),相关成果近期以《A Uterus-Inspired Niche Drives Blastocyst Development to the Early Organogenesis》为标题在《Advanced Science》发表。
2022-08-12
《流浪地球》《黑客帝国》等科幻电影中经常出现的体外生命再造,在现实生活中也是当今科学研究面临的挑战,代表性的是体外胚胎发育研究,用于探究生命发育的奥秘、解答临床生殖生育难题等,甚至改变分娩方式,解决生育意愿等问题。
干细胞与再生医学研究院顾奇研究员、王红梅研究员与中科院理化所王树涛研究员团队联合攻关,耗时近5年,开发仿生子宫,控制胚外组织迁移组装,模拟胚胎着床,首次成功将E3.5胚胎在体外发育至早期器官发生阶段(E8.5),相关成果近期以《A Uterus-Inspired Niche Drives Blastocyst Development to the Early Organogenesis》为标题在《Advanced Science》发表。
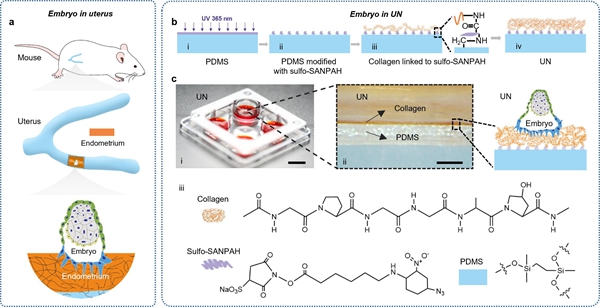
体外胚胎发育的关键是人造子宫的开发,胚胎在植入子宫过程中,涉及一系列机械物理和生物化学变化,这对于胚胎的发育至关重要,也是早期胚胎发育研究的“黑盒子”(Pan-Castillo et al., 2018)。目前还没有针对体外早期胚胎培养基底或三维环境的系统性研究,尤其是针对囊胚期之后的材料或三维环境要求。为了更有利于胚胎体外发育,联合团队首先系统分析子宫物理化学性质,将胶原凝胶接枝到聚二甲基硅氧烷上,筛选系列条件,最后成功模拟子宫微环境(仿生子宫(UN))来制备人造子宫(图1,图2)。这种全新而独特的仿生子宫系统支持胚胎入侵材料内部,可从微观直接观察胚胎与仿生子宫系统之间的特殊相互作用,并支撑E3.5胚胎发育至心跳阶段(E8.5)(图3)。创新点是宏观上通过生物材料模拟子宫环境延长胚胎培养,微观上揭示胚胎与材料的作用机制。联合攻关团队整合了发育生物学、材料科学、微纳制造等多学科手段,创建体外孕育生命的平台,促进了解早期胚胎发育的黑盒子,揭示了微环境如何影响胚胎发育,为体外延长胚胎培养提供理论依据。生物材料和力学生物学的引入为传统的发育生物学注入新的力量,是揭示胚胎发育机理的重要手段,并将为构建基于干细胞的胚胎模型提供解决方案。
图 1. 基于体内子宫微环境的仿生子宫(UN)系统设计。a) 胚胎附着于子宫内膜的示意图。森林绿,滋养外胚层;烟白色,外胚层;柠檬色,原始内胚层细胞;电子蓝,滋养外胚层衍生细胞;老虎黄,子宫内膜。b) 显示仿生子宫系统制备程序的示意图。c) 用于体外胚胎培养的仿生子宫示意图。i,包含仿生子宫系统的4孔培养板的数字图像。比例尺,1 cm。ii,带有胚胎附着位点示意图的培养基质横截面的放大图。比例尺,500 μm。iii,胶原蛋白、PDMS 和Sulfo-SANPAH的分子结构,其中Sulfo-SANPAH作为仿生子宫系统中胶原蛋白和PDMS之间的共价结合链接。
图 2. 仿生子宫系统的力学性能测试和形态特征。a) 通过单轴拉伸和AFM测试在拉伸和压痕两种模式下评估机械性能的示意图。老虎黄,子宫内膜;玛雅蓝,天然子宫;淡蓝色,脱细胞 (decell) 子宫。b) 脱细胞子宫的横截面和表面示意图。c) 通过单轴拉伸试验测量E3.5子宫角 (n = 32) 和PDMS (n = 20, 基体和交联剂的质量比为10:1) 的杨氏模量 (E)。d) 通过AFM测试测量子宫内膜 (E3.5) (n = 6) 和胶原蛋白 (n = 6, 7.5 mg/mL, 46 ± 10 μm 厚度) 的杨氏模量 (E)。e) 子宫角、子宫内膜、PDMS、胶原蛋白和培养皿的杨氏模量范围。f) decell E3.5子宫基质和胶原蛋白的横截面和表面的SEM图像。比例尺,3 μm(上图)和5 μm(下图)。g) decell E3.5子宫基质和胶原蛋白的横截面和表面的 SEM 图像的纤维直径 (i 和 iii) 和纤维网孔面积 (ii 和 iv)。ImageJ用于分析样品的纤维直径和孔面积。对于 (f) 和 (g),decell E3.5 子宫:n = 4 和 3 分别来自横截面和表面的子宫样本,每个样本统计 5 个图像; 胶原蛋白:n = 3 来自胶原凝胶的横截面和表面,分别计数每个样品的 5 个图像,7.5 mg/mL,厚度为 46 ± 10 μm。
图 3. IVC 小鼠胚胎的从围着床期到早期器官发生阶段的发育事件。a) 小鼠胚胎从植入前到早期器官发生阶段的示意图。E,胚胎时间。b)在体内和体外指定阶段生长的小鼠胚胎的代表性明场图像。白色虚线表示胚体。比例尺 = 100 μm。Day,体外培养日。黑色虚线表示胚胎区域中 A-P 轴的长度。c) 统一流形逼近和投影 (UMAP) 图,显示细胞图谱。根据下面的图例,单元格按其单元格类型注释着色。E6.5(14935 个细胞)、E8.5(15116 个细胞)、PDCO(21546 个细胞)、PD(16989 个细胞)。d) UMAP 嵌入覆盖显示来自指定胚胎的细胞来源。e)体内和体外胚胎总细胞中不同细胞类型的百分比。f) 体内和体外胚胎总细胞中早期和晚期胚胎发育细胞的百分比。早期发育,E6.5 胚胎中的细胞类型,晚期发育,除 E6.5 胚胎中的其他细胞类型。
干细胞与再生医学研究院顾奇研究员、王红梅研究员与中科院理化所王树涛研究员为共同通讯,北京科技大学顾振与中科院动物所郭佳、翟晶磊和冯桂海为论文的共同第一作者。上述研究工作得到了中国科学院A类战略性先导科技专项“器官重建与制造“(XDA16000000),中国科学院器官智造工程实验室项目(KFJ-PTXM-039),国家重点研发计划(2018YFE0201100),中国科学院青年团队项目(YSBR-012),王宽诚教育基金会(GJTD-2019-06),中央高校基本科研业务费(FRF-TP-20-019A2, FRF-BR-20-03B)等项目支持以及先导项目责任专家和监理专家的指导。

刘峰研究组合作研究揭示早期胚胎发育中RNA解旋酶Ddx3xb相分离调控母源mRNA翻译机制
近日,中国科学院北京基因组研究所杨运桂研究组和干细胞与再生医学研究院刘峰研究组合作在Cell Research杂志上发表了题为“Phase separation of Ddx3xb helicase regulates maternal-to-zygotic transition in zebrafish”的研究论文,揭示了早期胚胎发育过程中RNA解旋酶Ddx3xb通过相分离调控母源mRNA翻译的新机制。
2022-08-03
动物早期胚胎发育由存储在卵子中的母源因子(母源mRNA和蛋白)进行调控,逐步完成从母源因子主导到合子基因主导的过渡(母源-合子转换,maternal-to-zygotic transition, MZT),在此过程中, 母源mRNA稳定性及翻译的调控对母源-合子转换及胚胎发育的有序进行发挥着重要作用1。杨运桂/刘峰研究组的早期合作工作揭示了RNA m5C修饰及RNA结构变化调控母源mRNA稳定性2,3,从而促进母源-合子转换正常进行。然而,这个生物学过程的调控机制依然存在着很多未知。
近日,中国科学院北京基因组研究所杨运桂研究组和干细胞与再生医学研究院刘峰研究组合作在Cell Research杂志上发表了题为“Phase separation of Ddx3xb helicase regulates maternal-to-zygotic transition in zebrafish”的研究论文,揭示了早期胚胎发育过程中RNA解旋酶Ddx3xb通过相分离调控母源mRNA翻译的新机制。
该研究团队发现Ddx3xb在斑马鱼胚胎早期发育过程中高表达,随后一系列相分离分析实验发现其蛋白可以在体外/体内发生相分离,且其相分离活性主要依赖于其N端的内在无序区域 (intrinsically disordered region, IDR)。同时发现,在正常发育过程中,内源Ddx3xb蛋白相分离在受精后4小时发生,而不在更早的时期 (例如受精后2小时)。由于受精后4小时时期是母源-合子转换的关键时间点,暗示Ddx3xb相分离可能对母源-合子转换具有调控作用。研究组通过CRISPR/Cas9技术构建了Ddx3xb敲除的斑马鱼品系,并发现Ddx3xb敲除的斑马鱼胚胎发生了早期发育延迟现象。并且,该延迟表型能被全长型的Ddx3xb回补,但不能被无法发生相分离的N端内在无序区域缺失型Ddx3xb回补。
团队进一步通过组学及生化实验研究分子机制。RNA-seq数据表明Ddx3xb相分离可以调控母源mRNA的降解与合子基因的激活,表明Ddx3xb相分离在母源-合子转换过程中发挥了重要的分子调控作用。结合之前发表的斑马鱼早期发育RNA结构数据,团队发现与Ddx3xb结合的母源mRNA 5’UTR区域的结构在受精后4小时时期发生了显著性的开放,RNA解旋实验则表明Ddx3xb相分离可以促进其RNA解旋活性,而mRNA 5’UTR 的结构又可能对其翻译效率有着重要调控作用。团队进一步通过Ribosome profiling实验证明了Ddx3xb相分离可以提高与其结合的母源mRNA的翻译效率。
综上,该研究发现在斑马鱼早期胚胎发育过程中Ddx3xb可以在正常的生理条件下发生相分离,Ddx3xb相分离促进了与其结合的母源mRNA 5’UTR区域结构的开放,进而调控这些种类母源mRNA翻译的进行,最终影响母源-合子转换及早期胚胎发育(图1)。该工作拓展了相分离在生物学过程中的作用,有助于了解母源-合子转换过程中基因表达动态调控规律。
该文章被选为Cell Research封面论文(图2)。瑞士洛桑大学Nadine L. Vastenhouw教授等针对此研究在Cell Research同期发表题为“Maternally loaded RNAs: no time to die”的亮点评述。
该研究主要由中国科学院北京基因组研究所杨运桂研究员和干细胞与再生医学研究院刘峰研究员课题组合作完成,研究进行过程中还得到了清华大学李丕龙研究员,中国科学院北京基因组研究所赵永良研究员,北京脑科学与类脑研究中心Magdalena J Koziol研究员的大力帮助。
图1 Ddx3xb相分离调控母源mRNA结构及翻译示意图
图2 杂志封面故事: 该幅画描述了中国古代传说故事鹊桥相会。七夕之夜,喜鹊聚集成的鹊桥跨越天河,帮助牛郎织女相遇。Ddx3xb相分离(形成鹊桥)促进母源RNA降解(克服了天河的阻碍),进而帮助合子基因的激活(牛郎织女相见,纺织出的丝线象征着合子基因的转录)。
原文链接:
https://www.nature.com/articles/s41422-022-00655-5
亮点评述文章链接:
https://www.nature.com/articles/s41422-022-00670-6
参考文献:
1 Vastenhouw, N. L., Cao, W. X. & Lipshitz, H. D. The maternal-to-zygotic transition revisited. Development 146, doi:10.1242/dev.161471 (2019).
2 Yang, Y. et al. RNA 5-methylcytosine facilitates the maternal-to-zygotic transition by preventing maternal mRNA decay. Mol Cell 75, 1188-1202.e1111, doi:10.1016/j.molcel.2019.06.033 (2019).
3 Shi, B. et al. RNA structural dynamics regulate early embryogenesis through controlling transcriptome fate and function. Genome Biol 21, 120, doi:10.1186/s13059-020-02022-2 (2020).
焦建伟研究组揭示胚胎期小胶质细胞稳态调控神经发育的新机制
2022年7月20日,干细胞与再生医学研究院焦建伟研究团队在Molecular Psychiatry发表题为Microglia homeostasis mediated by epigenetic ARID1A regulates neural progenitor cells response and leads to autism-like behaviors的研究论文。该研究揭示了表观遗传因素ARID1A导致胚胎期小胶质细胞稳态失衡,造成神经前体细胞所处微环境的紊乱,进而损害神经发育的进程并导致自闭样行为的调控机制。
2022-07-21
神经系统(CNS)作为一个高度复杂、精密有序的结构,从早期胚胎发育的开始,就伴随着非神经组织的驻留。其中,小胶质细胞(Microglia)作为神经系统的固有免疫细胞,它来源于卵黄囊中的原始巨噬细胞,并在胚胎大脑发育形成血管时侵入大脑皮层内,在神经前体细胞周围聚集形成一个特殊的微环境,并构建出独特的免疫状态。越来越多的证据表明小胶质细胞通过直接相互作用或间接分泌细胞因子的方式调控神经发生(Neurogenesis)、突触修剪等过程,对神经发育过程中的网络构建发挥着重要功能。尽管小胶质细胞在脑发育过程中扮演着越来越重要的作用,但是仍然缺乏系统性的研究胚胎期的小胶质细胞对于神经前体细胞命运决定的调控机制。
2022年7月20日,干细胞与再生医学研究院焦建伟研究团队在Molecular Psychiatry发表题为Microglia homeostasis mediated by epigenetic ARID1A regulates neural progenitor cells response and leads to autism-like behaviors的研究论文。该研究揭示了表观遗传因素ARID1A导致胚胎期小胶质细胞稳态失衡,造成神经前体细胞所处微环境的紊乱,进而损害神经发育的进程并导致自闭样行为的调控机制。
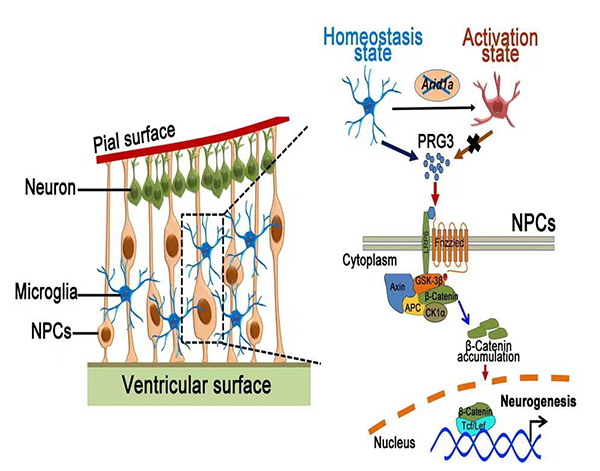
研究人员发现在胚胎期大脑神经发生过程中,小胶质细胞的稳态与神经前体细胞的维持和命运决定存在着重要的相互调控作用。其中,ARID1A作为SWI/SNF 染色质重塑复合体的核心亚基在小胶质细胞稳态重塑方面起着重要的调控作用。ARID1A缺失破坏了小胶质细胞中H3K9me3的表观修饰,导致小胶细胞稳态的失衡。随后失衡的小胶质细胞进一步通过改变神经前体细胞所处的微环境,损害了神经发生的过程,导致神经前体细胞库的耗竭和产生神经元的减少,进而导致成年小鼠产生了自闭样的行为缺陷。随后研究人员利用RNA-seq和CUT&Tag等基因组学方法,筛选出介导小胶质细胞与神经前体细胞“cross-talk”的分泌因子。小胶质细胞释放的PRG3因子通过驱动神经前体细胞内的Wnt/β-catenin 信号通路及其下游级联反应,从而导致了神经发生的紊乱。
该研究揭示了胚胎期神经发育过程之中,小胶质细胞的稳态与神经前体细胞相互作用的分子机理,将小胶质细胞作为胚胎神经发育内环境稳态调控的桥梁,在分子水平、细胞层面、双系统之间等多个层次,研究大脑皮层发育过程中不同系统之间体内微环境中细胞、分子的组成和网络结构,并深入探讨神经前体细胞在驻留免疫细胞环境下的自我更新和分化调控,为临床治疗提供理新的治疗方法和理论参考。
干细胞研究院焦建伟研究员为该论文的通讯作者,博士后苏立波和博士研究生张梦甜为该论文的共同第一作者。该研究获得了国家科技部、国家自然科学基金委、中国科学院先导等项目的资助。
论文链接:https://www.nature.com/articles/s41380-022-01703-7
细胞器稳态与疾病研究组在肿瘤干细胞研究领域取得新进展
细胞器稳态与疾病研究组在Cancer Letters上发表研究论文,报道了一个新的结直肠肿瘤干细胞特异表达膜蛋白LGR4。LGR4与正常结肠干细胞标志物LGR5同属于GPCR家族蛋白,但LGR4与LGR5的功能并不完全一致。LGR4在肝转移的结直肠肿瘤干细胞中表达升高。微组织芯片(Tissue micro-array)免疫组织化学染色和Oncomine数据库比对发现,LGR4与肿瘤干细胞转移关键蛋白PrPc表达水平正相关,因此研究人员推测LGR4可能与肿瘤的发生和转移相关。为此,研究人员从临床结直肠CD44+PrPc+肿瘤干细胞中分选出LGR4+和LGR4-亚群,并将其移植到免疫缺陷小鼠盲肠肠壁或皮下,发现LGR4+CD44+PrPc+细胞亚群比LGR4-CD44+PrPc+亚群具有更高的致瘤能力和转移能力。这些结果表明LGR4作为一个新的肿瘤干细胞表面标志蛋白,可用于富集肿瘤干细胞。
2022-06-15
恶性肿瘤严重威胁人类健康和生命。越来越多的证据表明,肿瘤细胞具有高度异质性(Heterogeneity)和可塑性(Plasticity)。肿瘤中的一小群具有无限增殖潜能的、能重建肿瘤发生的细胞被称作肿瘤干细胞(Cancer stem cell),又称肿瘤起始细胞(Tumour initiating cell)。肿瘤干细胞通过自我更新和分化在肿瘤中维持相对稳定的比例。肿瘤干细胞通常处于相对静止的细胞周期,对放疗和化疗药物不敏感,在某些刺激因子作用下重新进入细胞周期从而快速增殖,导致肿瘤的耐药和复发。此外,肿瘤干细胞可通过上皮-间充质转化(Epithelial-to-mesenchymal transtion)和免疫逃逸转移到远端,造成肿瘤转移。肿瘤干细胞是肿瘤发生、耐药、复发和转移的根本因素,也是导致肿瘤治疗失败的重要原因。因此寻找肿瘤干细胞特异的表面标志蛋白,将为开发靶向肿瘤干细胞的药物提供新的靶点。
近期,膜生物学国家重点实验室细胞器稳态与疾病研究组在Cancer Letters上发表研究论文LGR4 cooperates with PrPc to endow the stemness of colorectal cancer stem cells contributing to tumorigenesis and liver metastasis,报道了一个新的结直肠肿瘤干细胞特异表达膜蛋白LGR4。LGR4与正常结肠干细胞标志物LGR5同属于GPCR家族蛋白,但LGR4与LGR5的功能并不完全一致。LGR4在肝转移的结直肠肿瘤干细胞中表达升高。微组织芯片(Tissue micro-array)免疫组织化学染色和Oncomine数据库比对发现,LGR4与肿瘤干细胞转移关键蛋白PrPc表达水平正相关,因此研究人员推测LGR4可能与肿瘤的发生和转移相关。为此,研究人员从临床结直肠CD44+PrPc+肿瘤干细胞中分选出LGR4+和LGR4-亚群,并将其移植到免疫缺陷小鼠盲肠肠壁或皮下,发现LGR4+CD44+PrPc+细胞亚群比LGR4-CD44+PrPc+亚群具有更高的致瘤能力和转移能力。这些结果表明LGR4作为一个新的肿瘤干细胞表面标志蛋白,可用于富集肿瘤干细胞。
肿瘤重建(Tumor reestablishment)是肿瘤干细胞最重要的特征。为确认LGR4+CD44+PrPc+细胞是真正的肿瘤干细胞,研究人员建立了肿瘤类器官(Tumor organoid)实验体系。单个LGR4+CD44+PrPc+细胞可在Matrigel中生长出类似原代肿瘤表型特征的肿瘤类器官,原位移植单个肿瘤类器官到免疫缺陷小鼠盲肠肠壁即可成瘤。此外,LGR4+肿瘤干细胞通过自我更新和分化,在类器官和异体移植肿瘤中维持一定的比例,并产生普通肿瘤细胞(Non cancer stem cell),表明LGR4对肿瘤干细胞的干性维持和分化起到重要作用。
对肿瘤类器官进行基因编辑有助于探索单个基因对肿瘤干细胞的作用。敲低LGR4显著抑制肿瘤类器官的生长、肿瘤发生和转移,表明LGR4对于肿瘤干细胞干性维持的必要性。LGR4作为一个维持肿瘤干细胞干性的表面标志蛋白,可能是肿瘤干细胞治疗的潜在靶点,有望应用于临床抗肿瘤药物的开发。
相关研究2022年5月在线发表在Cancer Letters期刊上。干细胞研究院细胞器稳态与疾病研究组杜蕾副研究员和南开大学生命科学学院陈佺教授为本文的共同通讯作者。中国科学院动物研究所博士研究生程琪,南开大学博士研究生郑浩,北京肿瘤医院李明副主任医师、王洪义副主任医师是本文的共同第一作者。该研究成果得到国家重点研发计划、国家自然科学基金等多个项目的支持。
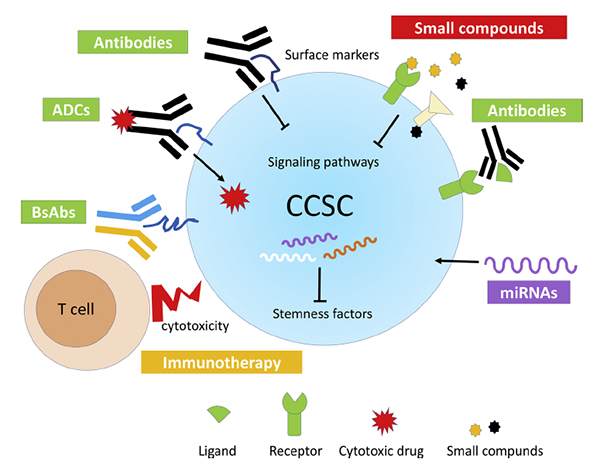
此外,细胞器稳态与疾病研究组近期受邀在Seminars in Cancer Biology期刊发表综述文章Targeting stemness of cancer stem cells to fight colorectal cancers,阐述靶向结直肠肿瘤干细胞应用于肿瘤治疗的可行性和研究现状。干细胞研究院细胞器稳态与疾病研究组杜蕾副研究员是本文的第一作者和共同通讯作者,南开大学生命科学学院陈佺教授是本文的共同通讯作者。
图:靶向肿瘤干细胞的策略。靶向肿瘤干细胞特异表达膜蛋白的单克隆抗体、 抗体偶联药物和双特异性单克隆抗体,靶向肿瘤干细胞特异信号通路的小分子化合物,以及靶向干性相关分子的抗体和小RNA,将有望应用于肿瘤药物的开发。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0304383522002099?via%3Dihub
https://www.sciencedirect.com/science/article/pii/S1044579X21000419?via%3Dihub

干细胞院建立蛋白工程化改造新方法和基于Cas12i的基因编辑新工具
干细胞与再生医学研究院的研究团队建立了一种蛋白质工程化改造的新方法(Improving Editing Activity by Synergistic Engineering,简称MIDAS),并利用该方法获得了高活性的Cas12iMax以及高特异性的Cas12iHiFi等基因编辑新工具。
2022-05-30
CRISPR-Cas基因组编辑技术在基因治疗、农作物经济性状改良以及基础研究等领域都有多样化的应用,引领生物技术与应用的快速发展。自然界中广泛存在的天然CRISPR-Cas系统为新型基因编辑工具研发提供了丰富资源。然而,自然界微生物中发现的大多数Cas工具蛋白在哺乳动物细胞中的编辑效率很低,这大大限制了它们的应用,尤其是在生物医学方面的应用。
干细胞与再生医学研究院的研究团队建立了一种蛋白质工程化改造的新方法(Improving Editing Activity by Synergistic Engineering,简称MIDAS),并利用该方法获得了高活性的Cas12iMax以及高特异性的Cas12iHiFi等基因编辑新工具。
研究发现,通过MIDAS方法能够显著提高来自不同CRISPR家族的Cas核酸酶,例如Cas12i,Cas12b以及CasX等CRISPR系统的基因编辑效率。其中Cas12i由于其较小的蛋白质尺寸、简单的crRNA以及PAM,具有较好的应用潜力。通过MIDAS方法改造的Cas12i具有以下优势和特点:(1)Cas12iMax编辑效率非常高,相较于目前广泛使用CRISPR基因编辑工具(AsCas12a,BhCas12b v4,SpCas9,SaCas9以及SaCas9-KKH),展现了更高的平均基因编辑效率。(2)Cas12iMax具有非常广泛的基因组靶向范围,能够高效地识别NTNN,NNTN,NAAN以及NCAN等PAM序列,可识别PAM覆盖了70%的人基因组。(3)在Cas12iMax的基础上进一步改造获得了新的突变体Cas12iHiFi。Cas12iHiFi在全基因组范围内展现了的极高的特异性和极低的脱靶效应,同时保留Cas12iMax 90%的On-target基因编辑活性。
MIDAS方法有望在多种CRISPR系统的基因编辑工具化改造中发挥作用,其中该研究所改造的新型Cas12i基因编辑工具在动物模型制备、作物育种、医学核酸检测、基因治疗等多项领域都具有广泛的应用前景。
相关成果于2022年5月26日在国际学术期刊The Innovation 发表。该研究工作由中国科学院动物研究所和北京干细胞与再生医学研究院完成。干细胞院研究员周琪和李伟为论文的通讯作者;博士生陈阳灿、胡艳萍、王鑫阁为共同第一作者。该研究得到国家重点研发计划、国家自然科学基金、中国科学院战略性重点研究项目和中国科学院基础研究青年团队项目的资助。
原文链接:https://www.cell.com/the-innovation/fulltext/S2666-6758(22)00060-1#relatedArticles
图1. 开发新型蛋白质工程化改造的方法,获得高效基因组编辑工具Cas12i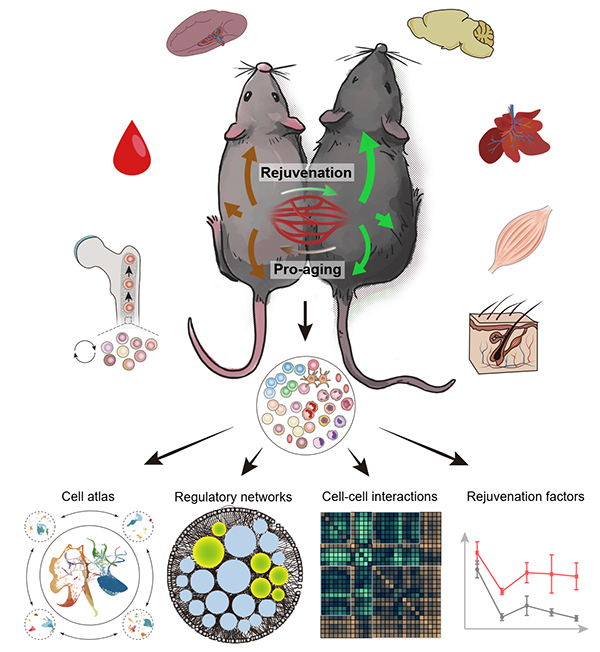
干细胞院合作揭示年轻血液促进干细胞及机体年轻化的分子机制
干细胞与再生医学研究院刘光慧研究组、曲静研究组,同中国科学院北京基因组研究所张维绮研究组合作,于Cell Stem Cell杂志在线发表题为“Heterochronic parabiosis induces stem cell revitalization and systemic rejuvenation across aged tissues”的研究论文。该研究通过构建年老小鼠和年轻小鼠的异体共生模型,绘制了系统水平的单细胞转录组图谱,并对骨髓、脾脏、外周血、脑、肝脏、骨骼肌和皮肤等7种组织器官进行了深入解析。研究发现,暴露于年轻血液可有效改善老年个体不同器官的组织微环境,并恢复多种成体干细胞的活力。其中,造血干(祖)细胞(HSPC)是对年轻血液尤为敏感的细胞类型之一,年轻的血液可以通过上调趋化因子CCL3的表达促进衰老HSPC的“年轻化”。该研究在单细胞分辨率揭示了异体共生引起的年老和年轻个体的细胞全景变化规律,揭示了年轻体内环境促进年老组织再生的关键介导因子,为发展衰老预警和干预的关键标志物和新型策略提供了重要的线索和思路。
2022-05-30
衰老是一种涉及全身多种组织器官系统性退化的过程,表现为渐进性机体再生能力减弱及功能衰退。异体共生(Heterochronic parabiosis)是通过外科手术连接年老和年轻小鼠的循环系统所构建的模型。该体系提供了一个独特的研究范式,可用于评价老化的机体受年轻血液影响后如何恢复活力,反之亦可用于研究年轻的组织和器官受衰老血液影响后加速退行的机制。迄今为止,年轻血液究竟靠何种力量使衰老个体重返“年轻态”的秘密还有待揭示。相关的重要科学问题包括:哪些衰老的器官、组织和细胞类型可以或者更容易被年轻血液“返老还童”?衰老干细胞的活力是否能被年轻血液所增强?能否发现介导年轻血液效应的“年轻因子”,并以此作为干预器官衰老的新型分子靶标?
2022年5月24日,干细胞与再生医学研究院刘光慧研究组、曲静研究组,同中国科学院北京基因组研究所张维绮研究组合作,于Cell Stem Cell杂志在线发表题为“Heterochronic parabiosis induces stem cell revitalization and systemic rejuvenation across aged tissues”的研究论文。该研究通过构建年老小鼠和年轻小鼠的异体共生模型,绘制了系统水平的单细胞转录组图谱,并对骨髓、脾脏、外周血、脑、肝脏、骨骼肌和皮肤等7种组织器官进行了深入解析。研究发现,暴露于年轻血液可有效改善老年个体不同器官的组织微环境,并恢复多种成体干细胞的活力。其中,造血干(祖)细胞(HSPC)是对年轻血液尤为敏感的细胞类型之一,年轻的血液可以通过上调趋化因子CCL3的表达促进衰老HSPC的“年轻化”。该研究在单细胞分辨率揭示了异体共生引起的年老和年轻个体的细胞全景变化规律,揭示了年轻体内环境促进年老组织再生的关键介导因子,为发展衰老预警和干预的关键标志物和新型策略提供了重要的线索和思路。
研究发现,暴露于年老个体的血液可以使年轻个体的不同器官、组织和细胞类型呈现加速衰老的特征。而年老个体受年轻血液影响则呈现出典型的“年轻化”改变,主要表现为衰老组织微环境的改善及相应干(祖)细胞的激活。被激活的干(祖)细胞群体包括皮肤的基底细胞和毛囊干细胞、骨骼肌的成纤维/脂肪祖细胞,以及定位于骨髓的HSPC。其中,衰老的HSPC对年轻血液的反应尤为敏感。以往的研究表明向淋系分化能力的减损是衰老HSPC的重要特征,该研究发现年轻血液暴露能上调老年个体HSPC中与淋系分化潜能相关的基因表达,并恢复骨髓中淋系细胞(如祖B细胞)的数量。结合差异基因表达、核心调控转录因子和细胞-细胞间通讯分析,研究团队发现了一系列以表观调控基因YY1以及细胞趋化因子CCL3为代表的HSPC衰老调控因子。结果显示,YY1的表达降低与HSPC老化密切相关,但其表达水平对年轻血液刺激缺乏足够响应性,而在衰老HSPC中被抑制的CCL3则可以被年轻血液诱导激活。进一步的小鼠移植实验发现,慢病毒介导的YY1过表达可有效增强年老的造血干(祖)细胞的重建能力;而基于CCL3过表达的“基因疗法”可显著提高年老造血干(祖)细胞向淋系分化的能力。
由于异体共生实验中年轻与年老个体的循环系统相通,因此个体之间可能存在彼此细胞(尤其是免疫类细胞)在不同组织器官中的相互混合。为了解析这一复杂的细胞互通情况,研究人员用CD45.1和CD45.2两种不同基因型为标记来区分异体共生年老和年轻小鼠的细胞,不仅通过流式技术分析了不同基因型个体来源的造血免疫细胞,还进一步构建了CD45不同基因型小鼠异体共生的单细胞转录组图谱。研究结果显示,异体共生系统中外周血和脾脏细胞的互通程度较高,而骨髓HSPC却很低(年轻个体中的HSPC仅有不到1%来源于年老个体,年老个体中年轻来源的HSPC也少于5%)。这一结果提示,年轻血液对老年HSPC的“促年轻化作用”是一种受到年轻血液影响后的细胞内源性变化。除了造血免疫系统,老年个体的外周实体组织也会被年轻血液“年轻化”。值得一提的是,研究人员发现Gilz在成纤维细胞中的表达改变可能是系统衰老和年轻化的关键调控因素。
综上所述,该研究以跨器官、多维度的形式系统解析了异体共生模型中年轻血液促使老年个体“年轻化”以及年老血液加速年轻个体“老化”的细胞分子变化规律,发现了多种调控体细胞及干细胞“年轻化”的关键因子,为建立衰老的新型预警和干预策略提供了丰富的数据资源,奠定了相关的理论基础。同时,该工作也为从系统生物学角度发现机体“年轻化因子”提供了新的研究范式,在科学应对老龄化方面具有潜在的应用价值。
该项研究由中国科学院动物研究所、中国科学院北京基因组所、中国科学院干细胞与再生医学创新研究院、北京干细胞与再生医学研究院、首都医科大学宣武医院、清华大学、中国农业大学、北京协和医院等机构合作完成。中国科学院动物研究所刘光慧研究员、中国科学院北京基因组研究所张维绮研究员、和中国科学院动物研究所曲静研究员为共同通讯作者。中国科学院动物研究所、北京干细胞与再生医学研究院马帅“致一”研究员、首都医科大学宣武医院王思研究员、中国科学院动物研究所叶燕霞助理研究员、中国科学院北京基因组研究所任捷研究员以及清华大学陈瑞轻博士为并列第一作者。研究得到清华大学王建伟教授、首都医科大学宣武医院陈彪教授、中国科学院动物研究所宋默识研究员、中国农业大学于舒洋教授的合作及支持。该研究获得科技部、国家自然科学基金委、中国科学院和北京市科委等项目资助。
原文链接:https://doi.org/10.1016/j.stem.2022.04.017
图1. 年轻血液促进机体多组织年轻化的系统生物学研究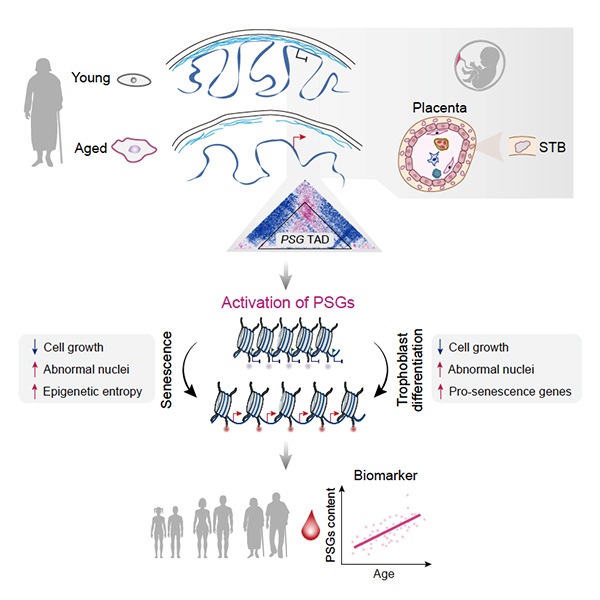
干细胞院合作揭示染色质的“熵增”是人类干细胞衰老的驱动力
干细胞与再生医学研究院刘光慧研究组、曲静研究组同中国科学院北京基因组研究所张维绮研究组合作,于Developmental Cell杂志在线发表题为“Large-Scale Chromatin Reorganization Reactivates Placenta-Specific Genes that Drive Cellular Aging”的研究论文。该研究通过深度解析人类干细胞衰老的表观基因组图谱,解码了衰老过程中不同层次表观基因组重塑的规律,发现染色质的“熵增”和胎盘相关基因的异常表达是细胞衰老的关键驱动力和分子标志物。该研究加深了人们对衰老程序化的认识,同时也为衰老的科学预警、衰老相关疾病的防治提供了潜在的评估策略和干预靶标。
2022-05-24
细胞衰老是机体衰老的重要标志和驱动因素,其中表观遗传改变是细胞衰老的重要特征之一。细胞衰老通常表现为细胞核形态异常、核纤层蛋白结构紊乱以及核周异染色质的缺失。然而,细胞衰老过程中表观基因组的重塑规律以及基因表达改变的调控机制尚不明确。通过系统地绘制细胞衰老过程中不同层次的表观遗传图谱、解析细胞衰老的表观基因组变化规律,有望发现对衰老敏感的表观基因组位点和调控衰老的关键基因,从而为解码细胞衰老的分子机制、揭示预警衰老的生物标志物以及衰老相关疾病的干预靶标提供新的线索。
2022年5月24日,干细胞与再生医学研究院刘光慧研究组、曲静研究组同中国科学院北京基因组研究所张维绮研究组合作,于Developmental Cell杂志在线发表题为“Large-Scale Chromatin Reorganization Reactivates Placenta-Specific Genes that Drive Cellular Aging”的研究论文。该研究通过深度解析人类干细胞衰老的表观基因组图谱,解码了衰老过程中不同层次表观基因组重塑的规律,发现染色质的“熵增”和胎盘相关基因的异常表达是细胞衰老的关键驱动力和分子标志物。该研究加深了人们对衰老程序化的认识,同时也为衰老的科学预警、衰老相关疾病的防治提供了潜在的评估策略和干预靶标。
该研究基于团队前期创建的人类干细胞衰老研究体系,综合运用DamID-seq、Hi-C、ChIP-seq(H3K9me3、H4K20me3、H3K27me3、H3K4me3、H3K36me3、H3K27ac、H3K4me1)、ATAC-seq和全基因组DNA甲基化测序(WGBS)等多维技术系统地绘制了人干细胞衰老过程中跨尺度、多层次、高分辨率的表观基因组图谱,以期探究干细胞在复制性衰老、病理性加速衰老过程中表观基因组的重塑规律。该研究深度解析了人间充质干细胞衰老过程中核膜和染色质互作的动态变化、染色质在细胞核中径向分布的大规模重排、染色质高级结构的重塑、精细的染色质状态的转变以及不同层次表观基因组信息的相互作用。研究人员发现衰老细胞的表观基因组呈现出染色质“刚性”的丢失和松弛性增加、表观基因组“熵”和混乱度的增加、“区室化”特征的减弱、全基因组表观信号的趋同性变化和“极性”的降低(激活性基因组区域和抑制性基因组区域表观特征丢失)等规律。研究人员将这种现象定义为“衰老中表观遗传景观的趋同性改变”,即“Convergent Alteration of the Epigenomic landscape during Aging”(CAEA),并首次提出胎盘、发育早期基因以及谱系非必要基因的表观“封印”解除和异位表达是人类细胞衰老的驱动力及分子标记物。
通过对不同层次表观基因组重塑规律的深度解析和整合,该研究揭示了人干细胞衰老过程中表观遗传调控的三个核心特征:
1) 对于抑制性基因组区域,细胞核“刚性框架”(核纤层结构)的丢失与异染色质的“腐蚀”、异染色质和核膜互作减弱、异染色质松弛、组成型异染色质修饰降低、DNA甲基化水平降低和染色质可及性的增加相关联。
2)对于激活性基因组区域,则表现为激活型特征的丢失,具体包括:激活型组蛋白修饰减少、染色质环互作强度降低及染色质可及性降低。
3)对于激活性和抑制性基因组区域的边界,发生了特征性的染色质区室“翻转”和“腐蚀”,具体表现为:边界处更易发生激活和抑制型区室的切换、兼性异染色质信号的丢失以及组成型异染色质和兼性异染色质的隔离“屏障”丢失以及相互入侵。
通过不同层次表观基因组重塑和基因表达特征的整合分析,该研究还建立了衰老细胞中基因组结构性变化和转录表达失调的联系,发现衰老细胞的表观基因组“势能”维持力的降低同衰老伴随的转录失调密切相关,整体激活和抑制性表观遗传特征的丢失和表观基因组的趋同性变化激活了抑制性区域中的谱系/发育特异基因以及多种类型重复元件家族(如:LTR/ERVs等)的异常表达,同时沉默了激活性区域的关键年轻基因(如:细胞周期基因等)的表达。该研究还鉴定出对衰老敏感的表观基因组区域,发现表观基因组的特定拓扑结构和表观状态的改变(与核膜距离趋远、多维表观基因组的去抑制和再激活)会导致位于同一个LAD/TAD中的胎盘发育相关基因簇——妊娠特异性糖蛋白(PSG)的协同激活表达。进一步研究发现,衰老过程中胎盘基因的异位激活是细胞衰老的驱动因素,过表达PSG4(PSG家族成员)可以驱动人类干细胞的衰老。另外,该研究还发现PSG4在老年人血液中的表达丰度显著升高,从而提示PSG4可以作为评估人类机体衰老程度的全新分子标志物。
该研究首次系统地描绘了人干细胞衰老的多层次表观基因组全景图,跨越多个表观基因组维度深入解析了细胞衰老过程中不同层次的表观基因组重塑规律及其与基因表达调控的密切联系。更为重要的是,该研究发现并确定了不同维度表观状态的协同变化所介导的胎盘相关基因PSG4的激活是机体衰老的新型分子标志物,指出了染色质三维结构紊乱所引起的早期发育基因的异常表达是人细胞衰老的驱动力。
总的来说,该研究结合多种衰老模型,提出了细胞衰老的新型表观基因组跨维度变化模式和理论框架,发现了人类衰老的新型标志物和驱动因素。这些发现将为衰老的表观基因组研究提供新的见解,为理解衰老的基因表达调控和关键信号通路提供新的方向,并为开发预防和治疗衰老相关疾病的新型干预靶标提供有力指导。
该研究由中国科学院动物研究所、中国科学院北京基因组研究所(国家生物信息中心)、首都医科大学宣武医院、北京医院、中国科学院上海生科院计算生物学研究所、华中农业大学等机构合作完成。干细胞与再生医学研究院刘光慧研究员、中国科学院北京基因组研究所张维绮研究员和中国科学院动物研究所曲静研究员为论文的共同通讯作者。中国科学院动物研究所博士研究生刘尊鹏、季乾昭,中国科学院北京基因组研究所任捷研究员,中国科学院动物研究所博士研究生颜鹏泽,中国科学院动物研究所特别研究助理武泽明和首都医科大学宣武医院王思研究员为论文的共同第一作者。该研究得到中国科学院动物研究所王红梅研究员、北京医院孙亮教授、华中农业大学曹罡教授以及中国科学院上海生科院计算生物学研究所魏刚研究员的指导与支持,并获得科技部、国家自然科学基金委、中国科学院和北京市等项目资助。
原文链接:https://doi.org/10.1016/j.devcel.2022.05.004
图1. 大规模表观基因组重塑引起的发育相关基因异常激活是人类干细胞衰老的驱动力
焦建伟研究组揭示脑血管内皮细胞调控神经前体细胞命运决定的新机制
2022年4月30日,干细胞与再生医学研究院焦建伟研究组在Advanced Science杂志上发表了题为Endothelial cells mediated by UCP2 control the neurogenic-to-astrogenic neural stem cells fate switch during brain development 的研究论文。这项工作揭示了脑血管内皮细胞在发育中的新皮质中调节神经前体细胞神经源性向胶质源性转变的作用机制。
2022-04-30
在哺乳动物新皮质发育过程中,神经前体细胞逐渐改变其特征和形态,依次形成神经元,星形胶质细胞和少突胶质细胞。顺序性分化是一种进化机制,神经元和胶质细胞的生成时间受到严格的调控。前期研究表明,神经系统的内外因素影响神经前体细胞神经源性向胶质源性转变。一个潜在的机制是神经前体细胞的内源因素,如神经前体细胞表面受体和转录因子。另一个潜在的机制是外源信号,如神经元分泌的因子。然而,除了神经系统以外,其他系统如血管是否影响神经前体细胞神经源性向胶质源性转变的机制仍然需要更加全面的研究。在神经前体细胞增殖和依次分化产生神经元和星形胶质细胞的同时,中枢神经系统变得血管化。由高特异性内皮细胞组成的脑血管系统作为神经前体细胞微环境的重要调节者,参与氧气和营养物质运输,监测细胞代谢等以维持正常的脑功能。然而,发育中的脑血管在调控神经前体细胞神经源性向胶质源性转变的机制尚不清楚。
2022年4月30日,干细胞与再生医学研究院焦建伟研究组在Advanced Science杂志上发表了题为Endothelial cells mediated by UCP2 control the neurogenic-to-astrogenic neural stem cells fate switch during brain development 的研究论文。这项工作揭示了脑血管内皮细胞在发育中的新皮质中调节神经前体细胞神经源性向胶质源性转变的作用机制。
线粒体是血管内皮细胞的信号细胞器,研究人员关注到内皮细胞中线粒体内膜分子UCP2。在这项研究中,他们发现随着发育的进行UCP2在血管内皮细胞中的表达水平逐渐升高。内皮细胞UCP2基因敲除导致内皮细胞代谢水平改变,减少血管直径。研究人员进一步发现,内皮细胞的紊乱导致神经前体细胞神经发生向胶质发生的过渡时间提前,最终导致神经元数目减少,星形胶质细胞数目增多。并且内皮细胞UCP2基因敲除导致小鼠出生后星形胶质细胞数目持续增加。研究人员进一步通过对脑血管内皮细胞进行RNA测序,发现糜蛋白酶 CMA1表达增强导致血管紧张素II (Ang II)分泌到内皮细胞外。内皮细胞来源的Ang II结合到神经前体受体(血管紧张素II 1a型受体,Agtr1a)进而激活JAK-STAT通路启动胶质发生。此外,抑制内皮细胞UCP2表达促进人神经前体细胞向星形胶质细胞分化,减少人神经前体细胞向神经元的分化。
综上所述,这项研究揭示了大脑发育中血管分泌重要的调控因子影响神经前体细胞顺序分化的新机制,为神经细胞发生向星形胶质细胞发生过渡时间的精确性调控提供了更加全面的理解,并且可以帮助我们更全面的认识胚胎期大脑皮层发育的复杂性,将更好理解大脑发育的进程和基本规律,为神经系统疾病的诊断提供理论基础。
中国科学院动物研究所焦建伟研究员为该论文的通讯作者,中国科学技术大学与中国科学院动物研究所联合培养博士研究生王稳稳和中国科学院动物研究所博士后苏立波为该论文的共同第一作者。该研究获得了国家科技部、国家自然科学基金委、中国科学院先导等项目的资助。
原文链接:http://doi.org/10.1002/advs.202105208
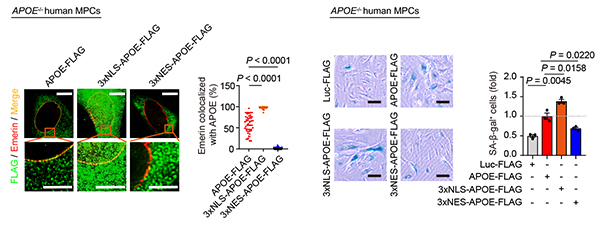
干细胞院合作揭示载脂蛋白APOE驱动干细胞衰老的新活性
2022年3月28日,干细胞与再生医学研究院刘光慧研究组、曲静研究组、宋默识研究组和中国科学院北京基因组研究所张维绮研究组合作,在Nature Aging杂志在线发表了题为“Destabilizing heterochromatin by APOE mediates senescence”的研究论文。该研究首次报道了细胞核中定位的APOE可与核膜以及异染色质相关蛋白相互作用,促进核纤层及异染色质蛋白的自噬性降解,进而破坏核周异染色质稳定性,导致人类干细胞的衰老。
2022-03-29
载脂蛋白E(APOE)作为一种经典的脂质结合蛋白,可以与胆固醇或其他脂质结合形成脂蛋白颗粒,从而介导中枢神经系统和外周组织中的脂质转运。越来越多的证据表明,APOE基因多态性与阿尔茨海默病、血管动脉粥样硬化以及人类寿命调控密切相关。尽管APOE一直以来被认为是阿尔茨海默病等衰老相关退行疾病的关键易感基因,但其在衰老调控中的作用和机制尚不明确。
2022年3月28日,干细胞与再生医学研究院刘光慧研究组、曲静研究组、宋默识研究组和中国科学院北京基因组研究所张维绮研究组合作,在Nature Aging杂志在线发表了题为“Destabilizing heterochromatin by APOE mediates senescence”的研究论文。该研究首次报道了细胞核中定位的APOE可与核膜以及异染色质相关蛋白相互作用,促进核纤层及异染色质蛋白的自噬性降解,进而破坏核周异染色质稳定性,导致人类干细胞的衰老。
研究人员发现,APOE的蛋白水平在多种人类干细胞衰老模型中均发生上调,提示APOE与人干细胞衰老调控的潜在联系。进一步研究显示,过表达APOE能够加速人干细胞衰老,而CRISPR/Cas9介导的APOE敲除可以延缓人干细胞衰老,说明APOE的聚积是细胞衰老的新型驱动力。机制分析表明,细胞核内的APOE可与内层核膜蛋白LBR、Emerin以及异染色质蛋白KAP1形成蛋白复合物。APOE通过自噬-溶酶体途径促进核膜蛋白和异染色质组分的降解,破坏核周异染色质的稳定性,进而导致基因组重复序列的去抑制及异常高表达,驱动人干细胞衰老。研究人员还发现,在多种人类细胞模型中敲低APOE均能延缓细胞衰老,说明APOE可作为减轻衰老及衰老相关病理的潜在分子靶标。
该研究首次揭示了APOE通过自噬-溶酶体途径破坏异染色质结构、加速细胞衰老的新型分子机制,拓展了人们对载脂蛋白APOE的新型生物学功能及机制的认知。考虑到APOE基因多态性与人类阿尔兹海默病等退行性疾病的密切联系,及其与长寿的关联,该研究将为衰老及衰老相关疾病的干预提供重要的线索和全新的思路。
Nature Aging杂志同期配发News & Views,对该研究进行积极评价。
该研究由中国科学院动物研究所、中国科学院干细胞与再生医学创新研究院、北京干细胞与再生医学研究院、中国科学院北京基因组研究所、首都医科大学宣武医院等机构合作完成。中国科学技术大学与中科院动物研究所联合培养博士研究生赵宏凯、中国科学院动物研究所博士研究生季乾昭、中国科学院特别研究助理武泽明以及首都医科大学宣武医院王思研究员为文章的并列第一作者。中国科学院动物研究所刘光慧研究员、曲静研究员、中国科学院北京基因组研究所张维绮研究员以及中国科学院动物研究所宋默识研究员为文章的共同通讯作者。该研究得到了中国科学院北京基因组研究所任捷研究员的指导和支持,同时获得了科技部、国家自然科学基金委、中国科学院及北京市等项目资助。
原文及评述链接:
https://www.nature.com/articles/s43587-022-00186-z
https://www.nature.com/articles/s43587-022-00190-3
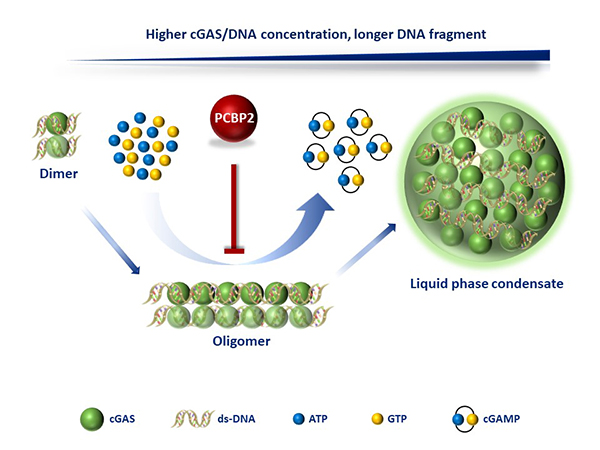
干细胞院合作发现PCBP2调控cGAS-DNA相变的机制
2022年3月23日,干细胞与再生医学研究院孙钦秒实验室和云南大学的陈大华实验室合作在Nature Communications杂志在线发表了题为“PCBP2 maintains antiviral signaling homeostasis by regulating cGAS enzymatic activity via antagonizing its condensation” 的论文。该工作发现PCBP2通过在体内和体外抑制cGAS-DNA的相分离来降低cGAS的酶活,进而维持cGAS介导的天然免疫反应平衡。
2022-03-22
环状GMP-AMP合成酶(cGAS)作为一种细胞质内识别DNA的受体,在机体抗DNA病毒和细菌的天然免疫反应中发挥着重要的作用。cGAS结合DNA后,催化合成第二信使cGAMP。cGAMP进一步与定位于内质网的接头蛋白STING结合,分别通过TBK1和IKK复合体激活转录因子IRF3和NF-κB,诱导干扰素和炎症因子的产生。同时,由于cGAS识别DNA的非特异性,它也可以识别宿主体内自身的DNA。大量研究发现cGAS功能的异常与感染性疾病、自身免疫疾病、衰老以及肿瘤的发生等密切相关。因此,cGAS活性必须受到严格的精准调控。
cGAS在体内和体外结合DNA后,都可以形成相分离,从而提高了cGAS的局部浓度,增强cGAS的酶活性,进而更有效地合成cGAMP。因此,cGAS-DNA相分离的动态调控对于其介导的信号通路的适时适量的启动和终止都是非常重要的。然而,目前对于cGAS-DNA的相分离的动态调控机制还不是很清楚。
2022年3月23日,干细胞与再生医学研究院孙钦秒实验室和云南大学的陈大华实验室合作在Nature Communications杂志在线发表了题为“PCBP2 maintains antiviral signaling homeostasis by regulating cGAS enzymatic activity via antagonizing its condensation” 的论文。该工作发现PCBP2通过在体内和体外抑制cGAS-DNA的相分离来降低cGAS的酶活,进而维持cGAS介导的天然免疫反应平衡。
研究人员为进一步解析cGAS的调控机制,首先通过免疫共沉淀实验结合质谱分析的方法,筛选到其中一个与cGAS有较强相互作用的蛋白PCBP2。通过功能分析,研究人员发现PCBP2过表达可明显减弱cGAS-STING的信号;而PCBP2的敲低或敲除可以显著增强DNA刺激或病毒感染后的天然免疫反应。在调控机制上,研究人员发现PCBP2在体外可以显著抑制cGAS-DNA的相分离和酶活。同时,在体内也观察到PCBP2的敲除显著增强cGAS的聚集,进而调控cGAS的酶活。这些研究结果不仅解析了cGAS介导的抗病毒免疫反应的调控机制,而且为以cGAS为靶点的感染性疾病、自身免疫疾病和癌症的治疗以及新药开发提供新的线索。
孙钦秒研究员和陈大华教授为该论文的共同通讯作者。中国科学院动物研究所博士研究生顾海艳、硕士研究生杨静、博士研究生张嘉宇为该论文的共同第一作者。该研究获得了国家自然科学基金委和膜生物学国家重点实验室等项目的资助。
文章链接:https://www.nature.com/articles/s41467-022-29266-9
