
科学研究
科研进展
刘峰研究组合作研究揭示早期胚胎发育中RNA解旋酶Ddx3xb相分离调控母源mRNA翻译机制
2022-08-03
动物早期胚胎发育由存储在卵子中的母源因子(母源mRNA和蛋白)进行调控,逐步完成从母源因子主导到合子基因主导的过渡(母源-合子转换,maternal-to-zygotic transition, MZT),在此过程中, 母源mRNA稳定性及翻译的调控对母源-合子转换及胚胎发育的有序进行发挥着重要作用1。杨运桂/刘峰研究组的早期合作工作揭示了RNA m5C修饰及RNA结构变化调控母源mRNA稳定性2,3,从而促进母源-合子转换正常进行。然而,这个生物学过程的调控机制依然存在着很多未知。
近日,中国科学院北京基因组研究所杨运桂研究组和干细胞与再生医学研究院刘峰研究组合作在Cell Research杂志上发表了题为“Phase separation of Ddx3xb helicase regulates maternal-to-zygotic transition in zebrafish”的研究论文,揭示了早期胚胎发育过程中RNA解旋酶Ddx3xb通过相分离调控母源mRNA翻译的新机制。
该研究团队发现Ddx3xb在斑马鱼胚胎早期发育过程中高表达,随后一系列相分离分析实验发现其蛋白可以在体外/体内发生相分离,且其相分离活性主要依赖于其N端的内在无序区域 (intrinsically disordered region, IDR)。同时发现,在正常发育过程中,内源Ddx3xb蛋白相分离在受精后4小时发生,而不在更早的时期 (例如受精后2小时)。由于受精后4小时时期是母源-合子转换的关键时间点,暗示Ddx3xb相分离可能对母源-合子转换具有调控作用。研究组通过CRISPR/Cas9技术构建了Ddx3xb敲除的斑马鱼品系,并发现Ddx3xb敲除的斑马鱼胚胎发生了早期发育延迟现象。并且,该延迟表型能被全长型的Ddx3xb回补,但不能被无法发生相分离的N端内在无序区域缺失型Ddx3xb回补。
团队进一步通过组学及生化实验研究分子机制。RNA-seq数据表明Ddx3xb相分离可以调控母源mRNA的降解与合子基因的激活,表明Ddx3xb相分离在母源-合子转换过程中发挥了重要的分子调控作用。结合之前发表的斑马鱼早期发育RNA结构数据,团队发现与Ddx3xb结合的母源mRNA 5’UTR区域的结构在受精后4小时时期发生了显著性的开放,RNA解旋实验则表明Ddx3xb相分离可以促进其RNA解旋活性,而mRNA 5’UTR 的结构又可能对其翻译效率有着重要调控作用。团队进一步通过Ribosome profiling实验证明了Ddx3xb相分离可以提高与其结合的母源mRNA的翻译效率。
综上,该研究发现在斑马鱼早期胚胎发育过程中Ddx3xb可以在正常的生理条件下发生相分离,Ddx3xb相分离促进了与其结合的母源mRNA 5’UTR区域结构的开放,进而调控这些种类母源mRNA翻译的进行,最终影响母源-合子转换及早期胚胎发育(图1)。该工作拓展了相分离在生物学过程中的作用,有助于了解母源-合子转换过程中基因表达动态调控规律。
该文章被选为Cell Research封面论文(图2)。瑞士洛桑大学Nadine L. Vastenhouw教授等针对此研究在Cell Research同期发表题为“Maternally loaded RNAs: no time to die”的亮点评述。
该研究主要由中国科学院北京基因组研究所杨运桂研究员和干细胞与再生医学研究院刘峰研究员课题组合作完成,研究进行过程中还得到了清华大学李丕龙研究员,中国科学院北京基因组研究所赵永良研究员,北京脑科学与类脑研究中心Magdalena J Koziol研究员的大力帮助。

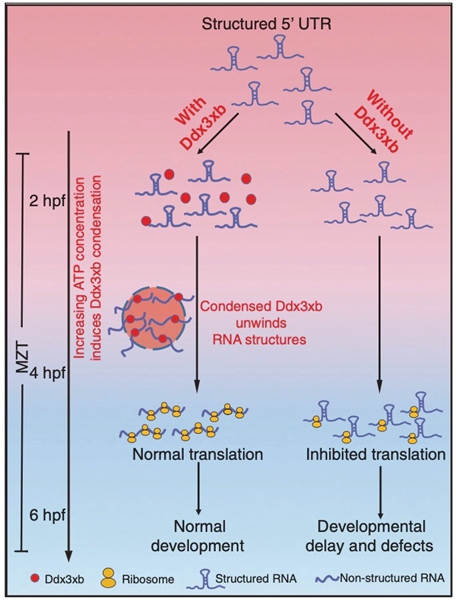
图1 Ddx3xb相分离调控母源mRNA结构及翻译示意图

图2 杂志封面故事: 该幅画描述了中国古代传说故事鹊桥相会。七夕之夜,喜鹊聚集成的鹊桥跨越天河,帮助牛郎织女相遇。Ddx3xb相分离(形成鹊桥)促进母源RNA降解(克服了天河的阻碍),进而帮助合子基因的激活(牛郎织女相见,纺织出的丝线象征着合子基因的转录)。
原文链接:
https://www.nature.com/articles/s41422-022-00655-5
亮点评述文章链接:
https://www.nature.com/articles/s41422-022-00670-6
参考文献:
1 Vastenhouw, N. L., Cao, W. X. & Lipshitz, H. D. The maternal-to-zygotic transition revisited. Development 146, doi:10.1242/dev.161471 (2019).
2 Yang, Y. et al. RNA 5-methylcytosine facilitates the maternal-to-zygotic transition by preventing maternal mRNA decay. Mol Cell 75, 1188-1202.e1111, doi:10.1016/j.molcel.2019.06.033 (2019).
3 Shi, B. et al. RNA structural dynamics regulate early embryogenesis through controlling transcriptome fate and function. Genome Biol 21, 120, doi:10.1186/s13059-020-02022-2 (2020).
附件:
