
科学研究
科研进展
生物制造研究组近期取得器官制造系列进展
2023-06-30
宏观血管网制造和微观细胞运动机制是大尺度复杂器官构建基础,生物制造研究组(https://www.gulab.info)近期通过开发微凝胶、修饰胶原及生物界面等研究手段的介入取得了器官制造的系列进展。
(1)复杂管网制造
血管网是营养物质传递的基础,是器官制造面临的首要难题。现有合成手段制造的血管虽然有较好的力学强度但活性低,无法与下一级血管形成互联,只能作为单一尺度的血管移植替代方案;已有报道能够实现模拟血管出芽,但是承压能力有限,无法满足大体积制造的需求。为了解决血管承压与生物活性不兼容的难题,中国科学院动物研究所顾奇、沈阳自动化所郑雄飞协同攻关,开发一种微凝胶增强的异质性水凝胶基质(3GF@GMM),结合前期已经发表的一体化打印技术(Adv Healthc Mater, 2021)构建多分支、跨尺度血管化组织,不仅耐受生理血流的剪切力和周向应力,并能模拟血管生成,向管道外出芽,提高营养物质的跨界面输送能力(图1)。相关研究工作以“3D bioprinting microgels to construct implantable vascular tissue”为题发表于Cell proliferation,该论文第一作者为中国科学院动物研究所博士后王新环,并列第一作者包括中国科学院动物研究所博士后刘鑫。
同时,在研究论文的基础上,对大尺度血管化组织中脉管系统制造进行综述,不仅概述了血管网的制造策略,还从设计、墨水、打印、培养四个方面进行了深度剖析,为下一步大尺度复杂组织/器官中的血管网制造奠定基础。相关综述以“Vascularized organ bioprinting: From strategy to paradigm”为题发表于Cell proliferation,该论文第一作者为沈阳自动化所副研究员王赫然和动物研究所博士后刘鑫。
(2)调控细胞三维空间运动
器官制造过程涉及复杂细胞运动,调控细胞/组织在三维环境中的有序组装和跨界面迁移,会为复杂器官制造中奠定理论和技术基础。
中国科学院化学研究所王树与动物研究所顾奇两个团队协同,利用化学修饰方法制备多种反应活性基团修饰的胶原基生物墨水可控胶原原纤维组装,提高内皮细胞的三维组装效率,打印成型的三维组织在培养7天后能够形成密集的内皮细胞组装形成的血管网络(图2)。相关研究工作以“Synthesis of Easily-Processable Collagen Bioinks using Ionic Liquid for 3D Bioprinted Liver Tissue Models with Branched Vascular”为题发表于Science China Chemistry,该论文第一作者为化学研究所高志强和动物研究所博士后刘鑫。
此外,跨界面细胞运动是组织融合生长的典型现象之一,动物研究所顾奇研究组通过微流控生产刚度可控的微载体,构建仿生胚胎,模拟胚外组织侵入子宫过程(图3)。相关研究工作以“Microcarriers promote the through interface movement of mouse trophoblast stem cells by regulating stiffness”为题发表于Bioactive Materials,该论文第一作者为动物研究所博士研究生高子力,郭佳(已毕业),及硕士研究生苟博(已毕业)。
上述工作得到了中国科学院战略性先导科技专项“器官重建与制造”(XDA16020802,XDA16020804)、国家自然科学基金(T2222029,U21A20396,62127811,22021002,22022705)、北京干细胞与再生医学院孵化基金(2022FH125)等项目支持。
论文信息:
1. 3D bioprinting microgels to construct implantable vascular tissue,论文网站链接:https://onlinelibrary.wiley.com/doi/10.1111/cpr.13456
2. Vascularized organ bioprinting: From strategy to paradigm,论文网站链接:https://onlinelibrary.wiley.com/doi/10.1111/cpr.13453
3. Synthesis of Easily-Processable Collagen Bioinks using Ionic Liquid for 3D Bioprinted Liver Tissue Models with Branched Vascular,论文网站链接:https://link.springer.com/article/10.1007/s11426-022-1472-6
4. Microcarriers promote the through interface movement of mouse trophoblast stem cells by regulating stiffness,论文网站链接:https://www.sciencedirect.com/science/article/pii/S2452199X23001524?via%3Dihub
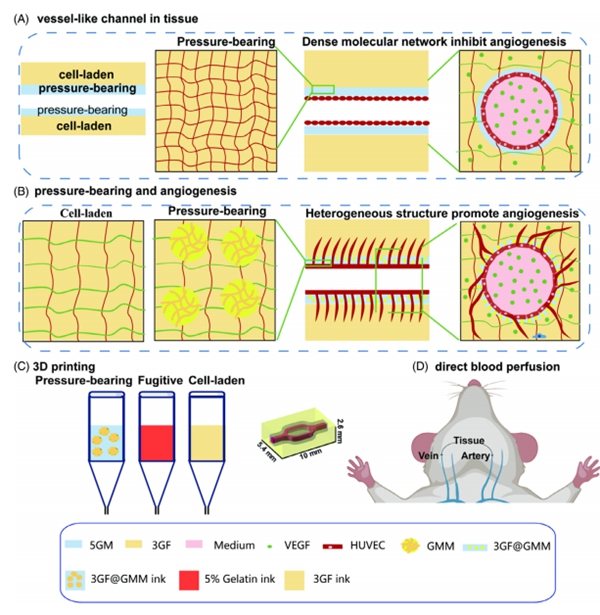
图1. 微凝胶增强的3GF血管基质满足生理血流剪切力、周向应力和血管生成
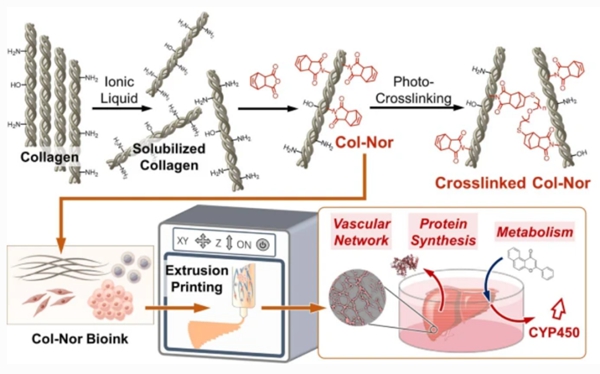
图2. 基于胶原蛋白的血管化组织制造
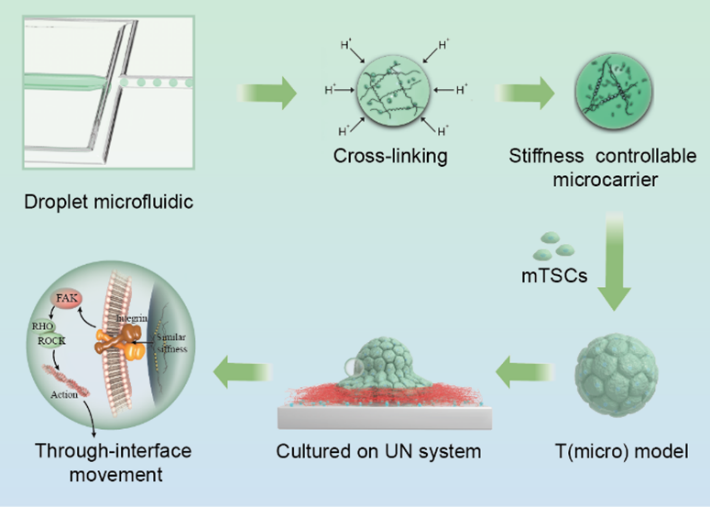
图3. 可控刚度微载体研究干细胞跨界面运动
附件:
